
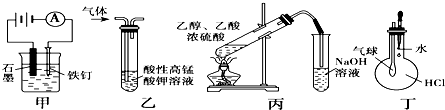
分析 A.作电解池阴极、原电池正极的金属被保护;
B.乙烯、乙炔都能被酸性高锰酸钾溶液氧化生成二氧化碳;
C.NaOH促进乙酸乙酯水解;
D.利用压强差大小确定HCl的溶解性强弱.
解答 解:A.作电解池阴极、原电池正极的金属被保护,该装置中Fe作阴极被保护,故A正确;
B.乙烯、乙炔都能被酸性高锰酸钾溶液氧化生成二氧化碳,所以不能用高锰酸钾溶液除去乙烯中的乙炔,故B错误;
C.NaOH促进乙酸乙酯水解,应该用饱和碳酸钠溶液收集乙酸乙酯,故C错误;
D.挤压胶头滴管,如果气球迅速鼓起来,说明烧瓶中压强变化大,从而证明氯化氢易溶于水,故D正确;
故选AD.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,注意从物质性质、实验操作规范性方面分析评价,易错选项是C,知道乙酸乙酯制取中饱和碳酸钠溶液的作用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(298K) |
| 硼酸 | K=5.7×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
| A. | 将一滴碳酸钠溶液滴入一硼酸溶液中一定能观察到有气泡产生 | |
| B. | 将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生 | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积的0.1 mol•L-1NaOH溶液:c(H2CO3)+c(H+)+c(HCO3-)=c(OH-)+c(CO32-) | |
| D. | 等物质的量浓度的碳酸溶液和醋酸溶液比较,pH:前者>后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙醇 | B. | 甲醇和乙醛 | C. | 丁烷和乙酸乙酯 | D. | 葡萄糖和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、Cl- | B. | Na+、NH4+、Cl- | C. | Cu2+、K+、Cl- | D. | K+、SO32-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 .下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )
.下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )| A. | HCl与之加成,生成CH3COCl | B. | CH3OH与之加成,生成CH3COCH2OH | ||
| C. | H2O与之加成,生成CH3COOH | D. | CH3COOH与之加成,生成  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质X、Y、Z有如图转化关系:请回答下列问题:
物质X、Y、Z有如图转化关系:请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)第一电离能介于B、N之间的第二周期元素有3种.
(1)第一电离能介于B、N之间的第二周期元素有3种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com