
 某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液.分析 锌比铜活泼,形成原电池反应时锌为负极,被氧化,铜为正极,正极发生还原反应,原电池工作时阳离子向正极移动,若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,铜被铁离子氧化,则铜为负极,石墨为正极,正极铁离子得到电子被还原生成亚铁离子,以此解答该题.
解答 解:(1)在甲图装置中,当电流计指针发生偏转时,形成原电池,锌为活泼金属,被氧化而失去电子,铜为原电池正极,正极上得电子而被还原,电极发生为Cu2++2e-═Cu,故答案为:正;Cu2++2e-═Cu;氧化;
(2)原电池中,电解质溶液中,阳离子向正极移动,阴离子向负极移动,即盐桥中K+移向乙烧杯的溶液,取出盐桥,不能形成闭合回路,则电流计指针不偏转,
故答案为:乙; 不偏转;
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,铜被铁离子氧化,则铜为负极,电极方程式为Cu-2e-═Cu2+,石墨为正极,正极铁离子得到电子被还原生成亚铁离子,电极方程式为2Fe3++2e-═2Fe2+(或Fe3++e-═Fe2+),
故答案为:2Fe3++2e-═2Fe2+(或Fe3++e-═Fe2+);Cu-2e-═Cu2+.
点评 本题考查原电池和电解池的工作原理,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握基础知识的积累,掌握电极反应式的书写.


 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | HClO的电子式为: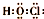 | |
| B. | 硝基苯的结构简式为: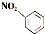 | |
| C. | 含18个中子的氯原子的核素符号:${\;}_{35}^{17}$Cl | |
| D. | 四氯化碳分子比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中只有离子键 | |
| B. | 非金属元素只能形成共价键 | |
| C. | 水分子中存在氢键,所以水的沸点较高 | |
| D. | 原子晶体的熔点不一定比金属晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
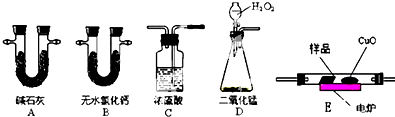
| 物理量 实验序号 | 燃烧有机物的质量 | ① | ② | ||
| 实验前质量 | 实验后质量 | 实验前质量 | 实验后质量 | ||
| 1 | m1 | m2 | m3 | m4 | m5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式为:CH3OCH3-12e-+12OH-═2CO2+8H2O | |
| B. | 二甲醚为不可再生能源 | |
| C. | 二甲醚分子中只含有极性键 | |
| D. | 二甲醚燃烧的热化学方程式表示为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-1455kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充入NO2 | B. | 升高温度 | ||
| C. | 减小压强,扩大容器体积 | D. | 增加压强,缩小容器体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
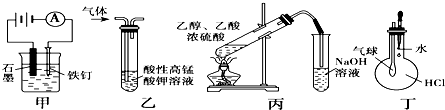
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2和酸性氯化亚铁溶液反应:2Fe2++H2O2+2 H+═2Fe3++2H2O | |
| B. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+2Ca2++4OH-═2CaCO3↓+Mg(OH)2↓+2H2O | |
| C. | 3 mol的Cl2通入含2 mol FeI2的溶液中:2Fe2++4I-+3Cl2═2Fe3++6Cl-+2I2 | |
| D. | 将SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O═CaSO3+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫酸铝钾中阴离子所带电荷总数为2NA | |
| B. | 等质量的乙炔和苯分别完全燃烧,乙炔和苯都消耗7.5NA个氧气分子 | |
| C. | 将0.1mol碳酸钠溶于1L水中,所得溶液含有CO32-和HCO3-共0.1NA个 | |
| D. | 在H2O2作燃料电池的负极原料时,每摩尔H2O2转移的电子数为2 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com