
两份质量相同的CH4和NH3比较,下列结论错误的是
A.分子个数比为17∶16 B.原子个数比为17∶16
C.氢原子个数比为17∶12 D.氢原子质量比为17∶12
科目:高中化学 来源:2016-2017学年安徽省高二上月考一化学试卷(解析版) 题型:填空题
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式:
口H2PO2-+口Ag++口________=口PO43-+口Ag+口________
(2)由工业白磷(含少量砷、铁、镁等)制备高纯白磷(熔点44℃,沸点280℃),主要生产流程如下:

①关于除砷条件的说法合理的是__________(填字母)。
a.75℃使白磷熔化,并溶于水 b.硝酸浓度不易过大,防止白磷反应
c.温度不易过高,防止硝酸分解 d.适当提高温度,加快化学反应速率
②硝酸氧化除砷时被还原为NO,氧化相同质量的砷.当转化为亚砷酸的量越多,消耗硝酸的量越 _____________(填“多”或“少”)。
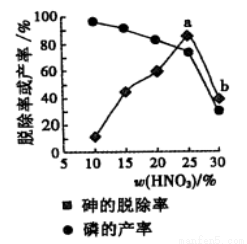
③某条件下,用一定量的硝酸处理一定量的工业白磷,砷的脱除率及磷的产率随硝酸质量分数的变化如右图,砷的脱除率从a点到b点降低的原因是_____________。
(3)某温度下,已知:
Ag+(aq)+2NH3(aq)  Ag(NH3)2+(aq) k1=1.10×107
Ag(NH3)2+(aq) k1=1.10×107
AgCl(s) Ag+(aq)+Cl-(aq) K2=1.45×10-10
Ag+(aq)+Cl-(aq) K2=1.45×10-10
①反应平衡常数的表达式K1=______________。
②计算可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=___________(保留2位有效数字)。
③1Llmol/L氨水中最多可以溶解AgCl__________mol(保留1位有效数字,忽略溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上9月月考化学试卷(解析版) 题型:选择题
设NA代表阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,18gH218O所含质子数为10NA
B.1 mol乙醇中含有极性键的 数目为8NA
数目为8NA
C.1mol的﹣NH2与1molNH4+所含电子数均为10NA
D.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上月考一化学试卷(解析版) 题型:选择题
某溶液中含有大量的的Cl-、CO32-、OH-等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是:①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液.
A. ①②④②③ B. ④②①②③ C. ①②③②④ D. ④②③②①
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上月考一化学试卷(解析版) 题型:选择题
下列混合物的分离和提纯方法中,主要是从溶解性的角度考虑的是
A.蒸发 B.蒸馏 C.洗气 D.萃取
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上月考一化学试卷(解析版) 题型:选择题
下列说法正确的是
A.摩尔是国际单位制中的七个基本物理量之一
B.1molO2中约含有6.02×1023个O2
C.1mol任何物质都含有6.02×1023个原子
D.摩尔表示物质的量
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上10月月考化学卷(解析版) 题型:实验题
测定中和反应的反应热的实验步骤如下:
①用量筒量取50ml0.25mol/L硫酸倒入小烧杯中,测出硫酸溶液温度
②用另一量筒量取50ml0.55mol/LNaOH溶液,并测出其温度
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度
回答下列问题:
(1)倒入NaOH溶液的正确操作是 。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是 。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)实验数据如下表:
温度 溶液 试验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后混合溶液的比热容c=4.18J/(g·℃)。利用上表数据计算该中和反应的反应热△H= (保留一位小数);写出上述中和热的热化学方程式 。
②利用上表数据计算出的中和热与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.量取NaOH溶液的体积时仰视读数
d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学卷(解析版) 题型:实验题
某同学欲配制480 mL 物质的量浓度为0.1mol.L-1的CuSO4溶液。
(1)完成该实验用到的仪器主要有:托盘天平、胶头滴管、____________,烧杯、玻璃棒、药匙。
(2)如果用CuSO4固体来配制,应该称量固体的质量为_________________。如果用CuSO4.5H2O来配制,应该称量固体的质量为____________________。
(3)写出整个实验简单的操作过程:计算→__________→溶解→转移→洗涤→____________→摇匀。
(4)定容时的正确操作是:待容量瓶中的液体液面距离容量瓶的刻度线1 ~2 cm时,改用___________滴加,并且目光要平视刻度线,至______________,定容完成。
(5)下列操作对溶液的浓度有何影响?用“偏大”“偏小”或“无影响”填空。
① 配制的过程中有少量的液体溅出烧杯。( )
② 使用前容量瓶用蒸馏水洗涤,且没有干燥。( )
③ 定容时俯视液面。( )
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学卷(解析版) 题型:选择题
盖斯定律指出:化学反应的反应热只与反应的始态和终态有关,而与具体反应进行的途径无 关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
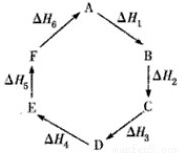
A.A→F:ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F:|ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com