
 的混合物与金属钠反应,生成的烷烃不可能是( )
的混合物与金属钠反应,生成的烷烃不可能是( )| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH2CH2CH3 | D. | CH3CH2CH(CH3)2 |
分析 根据题干信息可知该反应的原理为:碳卤键发生断裂,卤原子与钠形成卤化钠,与卤原子相连的碳相连形成新的碳碳键,类比该原理分析CH3CH2Br和(CH3)2CHBr 是否能够单独或者相互之间反应生成选项中各物质.
解答 解:A.CH3CH2Br与金属钠按照1:1反应能够生成CH3CH2CH2CH3和溴化钠,故A错误;
B.CH3CH2Br和(CH3)2CHBr与金属钠无论单独反应还是一起反应都无法得到CH3CH2CH2CH2CH3,故B正确;
C.(CH3)2CHBr与钠以1:1发生反应能够生成2,3-二甲基丁烷((CH3)2CHCH2CH2CH3)和溴化钠,故C错误;
D.CH3CH2Br和(CH3)2CHBr与金属钠以1:1发生反应能够生成2-甲基丁烷(CH3CH2CH(CH3)2)和溴化钠,故D错误;
故选B.
点评 本题考查了卤代烃的化学性质,题目难度不大,正确分析题干反应原理并得出正确的结论是解本题关键,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Li为电池的负极 | |
| B. | 充电时阳极反应式为:4Cl-+S+SO2-4e-═2SOCl2 | |
| C. | 电池的电解液可用LiCl水溶液代替 | |
| D. | 放电时电子从负极经外电路流向正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,B在元素周期表的位置第二周期IVA族;
,B在元素周期表的位置第二周期IVA族; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
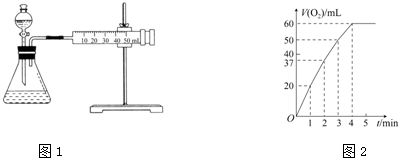
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 经测定某物质只含一种元素,则该物质一定是单质 | |
| B. | 阳离子、阴离子中均分别只含一种元素,则由这样的阴、阳离子组成的物质一定为纯净物 | |
| C. | 既能和酸反应又能和碱反应的化合物一定为两性化合物 | |
| D. | 酸性氧化物均可与强碱反应,碱性氧化物都是金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
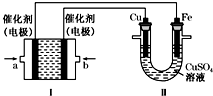 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、NaCl、SO2、NaCl溶液 | B. | BaSO4、SO3、CuSO4晶体、Na2O2 | ||
| C. | NaCl、H2S、CO2、Cu | D. | SO3、AgCl、NH3、H2O、Ag |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com