
分析 (1)氰化钠是离子化合物,钠元素化合价+1价,氢元素-1价;
(2)元素化合价升高的物质做还原剂,元素化合价降低的物质做还原剂,结合化学方程式计算氧化剂和还原剂物质的量之比;
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,依据氧化还原反应电子守恒和原子守恒配平书写化学方程式;
(4)过氧化钠和二氧化碳反应生成氧气,氧气能使带火星的木条复燃;
解答 解:(1)氢化钠(NaH)中钠元素化合价+1价,化合物中元素化合价代数和为0,则氢元素的化合价为-1价,
故答案为:-1价;
(2)NaH能与水剧烈反应:NaH+H2O═NaOH+H2↑,NaH中氢元素化合价-1价变化为0价,做还原剂,H2O中氢元素化合价+1价变化为0价做氧化剂,该反应中的氧化剂是H2O,氧化剂和还原剂物质的量之比1:1,
故答案为:H2O,1:1;
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,氢元素化合价升高为+1价,钛元素化合价+4价变化为0价,则反应的化学方程式为:2NaH+TiCl4═Ti+2NaCl+2HCl↑或NaH+TiCl4=Ti+4NaCl+2H2↑,
故答案为:2NaH+TiCl4═Ti+2NaCl+2HCl↑或NaH+TiCl4=Ti+4NaCl+2H2↑
(4)过氧化钠是呼吸面和防毒面具中氧气的来源,过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,证明有氧气产生的方法是用带火星的蚊香或火柴插入试管中,如果复燃,则证明有氧气产生,
故答案为:2Na2O2+2H2O=4NaOH+O2↑,用带火星的蚊香或火柴插入试管中,如果复燃,则证明有氧气产生.
点评 本题考查了物质性质的,氧化还原反应概念和定量关系,化学方程式书写,注意知识积累,题目较简单.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中滴加NaOH溶液并加热,用湿润的蓝色石蕊试纸于试管口以检验NH4+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 某待测液焰色反应呈黄色,则待测液中一定不含有K+ | |
| D. | 某溶液中加入KSCN后,溶液无变化,再加入H2O2后,溶液变成血红色,说明原溶液中一定含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
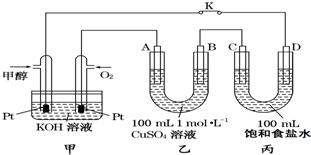 如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.
如图是甲醇(CH3OH)燃料电池工作的示意图,其中A、B、D均为石墨电极,C为铜电极.工作一段时间后,断开K,此时A、B两极上产生的气体体积相同.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com