
| A. | 向某溶液中滴加NaOH溶液并加热,用湿润的蓝色石蕊试纸于试管口以检验NH4+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 某待测液焰色反应呈黄色,则待测液中一定不含有K+ | |
| D. | 某溶液中加入KSCN后,溶液无变化,再加入H2O2后,溶液变成血红色,说明原溶液中一定含有Fe2+ |
分析 A、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,可以确定有NH4+,;
B、钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀;
C、钾离子的焰色反应呈现紫色需要通过钴玻璃才能看见;
D、亚铁离子能被氧化剂氧化为铁离子,铁离子遇到硫氰化钾显示红色.
解答 解:A、湿润红色石蕊试纸遇碱性物质变蓝,加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+,故A错误;
B、氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,可有SO42-或是氯离子中的一种,故B错误;
C、测液焰色反应呈黄色,则待测液中是否含有K+无法判断,因为钾离子的焰色反应呈现紫色需要通过钴玻璃才能看见,故C错误;
D、溶液中加入KSCN后,溶液无变化,不含有铁离子,再加入H2O2后,溶液变成血红色,证明含有的亚铁离子被氧化为铁离子,故一定含有亚铁离子,故D正确.
故选D.
点评 本题考查了常见离子的检验,题目难度中等,注意掌握常见离子的性质及检验方法,在检验离子存在时,必须排除干扰离子,做到实验方案的严密性;选项B为易错点,注意可能存在与一定存在的关系.


科目:高中化学 来源: 题型:选择题
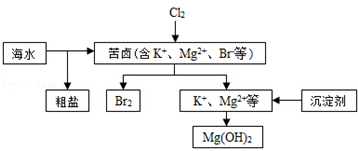
| A. | 向苦卤中通入Cl2是为了提取溴 | |
| B. | 粗盐可采用除杂、过滤、蒸发结晶等过程提纯 | |
| C. | 工业生产常选用NaOH作为沉淀剂 | |
| D. | 单质溴可用SO2将其还原吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | c点的操作是拉伸注射器 | |
| B. | b点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb | |
| D. | d点:v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,电解质溶液的pH不断降低且正负极均有PbSO4 生成 | |
| B. | 放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4 | |
| C. | 充电时,阳极反应:PbSO4+2e-=Pb+SO42- | |
| D. | 充电时,铅蓄电池的负极与外接电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 适当增大压强 | ||
| C. | 加入催化剂 | D. | 从容器中分离出氨 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )| A. | 反应达到平衡时N2的转化率:M<N | B. | H2的体积分数:M<N | ||
| C. | NH3的浓度:M<N | D. | 该反应在T℃时的平衡常数K:M=N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2O所含的分子数为NA | |
| B. | 常温常压下,1 mol HD含有中子总数为2NA | |
| C. | 常温常压下,32 g O2中含有的分子数为NA | |
| D. | 100 mL 1 mol•L-1K2SO4溶液中含有的钾离子数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com