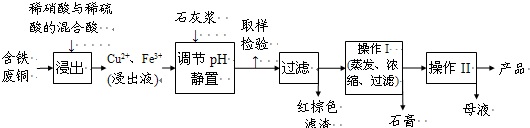
I.硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO
4?5H
2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表.
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
| 石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
| 胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是
Fe(OH)3
Fe(OH)3
;
(2)写出浸出过程中生成硫酸铜的化学方程式
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O
;
(3)操作I的操作温度应该控制在
100
100
℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为
冷却结晶、过滤
冷却结晶、过滤
、洗涤、干燥;
(5)取样检验是为了确认Fe
3+是否除净.有同学设计了以下两种方案,在实验室分别对所取样品按下列方案进行操作:
方案一:取样于试管→滴加KSCN溶液;
方案二:径向层析→喷KSCN溶液
①你认为上述两种方案设计更合理的是
方案二
方案二
;
②指出你认为不合理的方案存在的问题
Cu2+的蓝色对检验有干扰
Cu2+的蓝色对检验有干扰
;
(6)反应产物中的NO可以循环使用,用化学方程式表示循环使用的方案
4NO+3O2+H2O=4HNO3
4NO+3O2+H2O=4HNO3
.
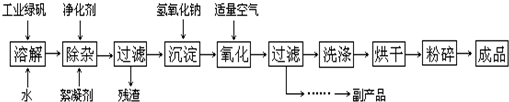
II.(12分)复印机使用的墨粉主要成份是Fe
3O
4,图是氧化沉淀法生产Fe
3O
4的工艺:
已知:
①工业绿矾中FeSO
4的含量为52.5%,其中的杂质不参与反应;
②Fe(OH)
2+2Fe(OH)
3═Fe
3O
4?4H
2O
请回答下列问题:
(1)铁的常见氧化物有
FeO、Fe2O3、Fe3O4
FeO、Fe2O3、Fe3O4
;
(2)Fe
3O
4与盐酸反应的化学方程式是:
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
,检验反应后的溶液中含Fe
3+的方法:
取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+
取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+
;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:
4Fe(OH)2+2H2O+O2=4Fe(OH)3
4Fe(OH)2+2H2O+O2=4Fe(OH)3
;
(4)生产中可获得的副产品是
Na2SO4?10H2O
Na2SO4?10H2O
,提取该副产品的操作顺序是:
bcdae
bcdae
(填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16kg/h,为使产品较纯,鼓入空气的速率应为
0.784
0.784
m
3/h(假设反应在标准状态下进行,空气中O
2占20%).

 =0.1L,即100ml,
=0.1L,即100ml,

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

