
二氧化氮在加热条件下能够分解成一氧化氮和氧气,该反应进行到45s时达到平衡,NO2的浓度约为0.0125,mol·L-1,如图所示中曲线表示二氧化氮分解反应在前25s内的反应进程.
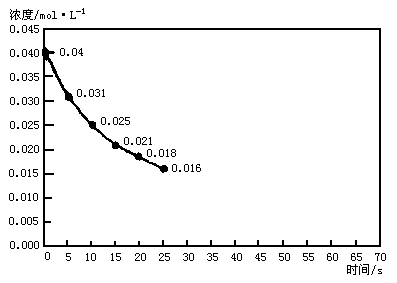
(1)请计算前20s内氧气的平均生成速率.
(2)若反应延续至70s,请在图中用实线画出25s至70s的反应过程曲线.
(3)若在反应开始时加入催化剂(其他条件不变),请在图上用虚线画出加入催化剂的反应过程曲线.
(4)写出该反应的化学平衡常数表达式.
|
(1)解:2NO2 v(O2)= (2)如图中实线
(3)如图中虚线
(4)K= 导解:(2)随着反应进行,c(NO2)不断降低,直至45s达到平衡时,c(NO2)降至0.0125mol·L-1,以后不再变化.作图时,先连点(25,0.016)与(45,0.0125),用平滑线连接,然后由点(45,0.0125)作平行于横坐标的直线. (3)若在反应开始时就加入催化剂,由于催化剂会大大加快反应速率,而不改变平衡状态的组成,所以画曲线时,注意两点:一是曲线斜线比没加催化剂时曲线斜率大,二是到达平衡时所需时间短. (4)根据平衡常数定义可写出相应表达式. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
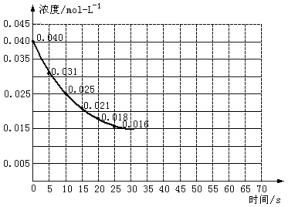
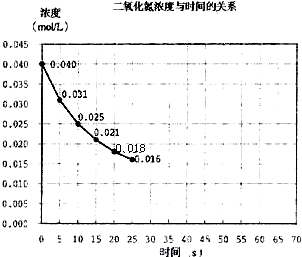 (2000?上海)二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.
(2000?上海)二氧化氮在加热条件下能够分解成一氧化氮和氧气.该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L).图中的曲线表示二氧化氮分解反应在前25秒内的反应进程.| c2(NO)?c(O2) |
| c2(NO2) |
| c2(NO)?c(O2) |
| c2(NO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
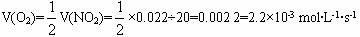
二氧化氮浓度与时间的关系
(1)请计算前20秒内氧气的平均生成速率。
(2)若反应延续至70秒,请在图中用实线画出25秒至70秒的反应进程线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。下图中的曲线表示二氧化氮分解反应在前25s内的反应进程。
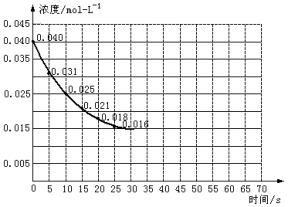
(1)请计算20s内氧气的平均生成速度。
(2)若反应延续至70s请在图中用实线画出25至70s的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线。
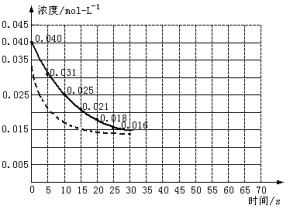
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45 s时,达到平衡(NO2浓度约为0.0125 mol·L-1)。图24中的曲线表示二氧化氮分解反应在前25 s内的反应进程。
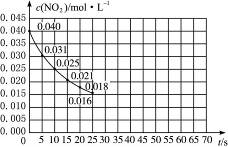
图2-4
(1)请计算前20 s内氧气的平均生成速率。
_______________________________________。
(2)若反应延续至70 s,请在上图中用实线画出25 s至70 s的反应进程曲线。
(3)若反应开始时加入催化剂(其他条件都不变)请在图上用虚线画出加入催化剂后的反应进程曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到45秒时,达到平衡(NO2浓度约为0.0125mol/L)。下图中的曲线表示二氧化氮分解反应在前25s内的反应进程。
(1)请计算20s内氧气的平均生成速度。
(2)若反应延续至70s请在图中用实线画出25至70s的反应进程曲线。
(3)若在反应开始时加入催化剂(其他条件都不变),请在图上用虚线画出加催化剂后的反应进程曲线。
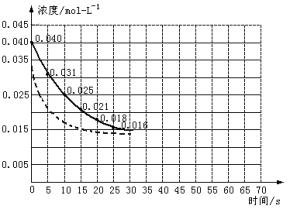
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com