
(14分)
Ⅰ.(1)分析下表中各项的排布规律,按此规律排布第22项应为 。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C2H4 | C2H6 | C2H6O | C2H4O2 | C3H6 | C3H8 | C3H8O | C3H6O2 | C4H8 | C4H10 |
(14分)
Ⅰ.(1)C7H16 (2分) (2)②④ (2分)
Ⅱ.(1)N、S (各1分)
(2)HC2O4-  C2O4- + H+
C2O4- + H+
HC2O4-+H2O H2C2O4 + OH-
H2C2O4 + OH-
HC2O4-的电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性(2分)
c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-) (2分)
(3)①(NH4)2Fe(SO4)2·6H2O (2分) ②5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O(2分)
解析试题分析:Ⅰ(1)此题为中档题,其实这道题更象是一个简单的数学题,不需要过多的化学知识,不过学生平时估计也碰到过这种找多少项为什么的类似题。有多种做法,比如我们把它分为4循环,22=4*5+2,也就是说第20项为C6H12O2,接着后面就是第22项为C7H16,这里面要注意的是第一项是从2个碳原子开始的。(2)取代反应是指有机化合物分子里的某些原子或原子团被其它原子或原子团所代替的反应。Ⅱ(1)A与E,D与F分别同主族,A能与B、C、D分别形成电子数相等的三种分子,可知A为H元素,E为Na元素,B为C元素,C为N元素,D为O元素,F为S元素。(2)A2B2D4为H2C2O4(草酸,弱酸),与等物质的量的KOH溶液反应的方程式为:H2C2O4+KOH=KHC2O4+H2O,溶液中含有HC2O4-,即水解HC2O4-+H2O H2C2O4 + OH-,也电离HC2O4-
H2C2O4 + OH-,也电离HC2O4-  C2O4- + H+,电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性,其各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-)。(3)①加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体,可推知Z中含有NH4+;白色沉淀迅速变为灰绿色,最终变为红褐色,可推知Z中含有Fe2+;加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,可推知Z中含有SO42-,结合化合物Z(相对分子质量为392),1molZ中含有6mol结晶水,可得Z的化学式为(NH4)2Fe(SO4)2·6H2O。②KMnO4溶液(硫酸酸化)具有强氧化性,把Fe2+氧化成Fe3+,其离子方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O。
C2O4- + H+,电离程度大于水解程度,使溶液中C(H+) > C(OH-) ,所以KHC2O4溶液显酸性,其各离子浓度由大到小的顺序为c(K+)>c(HC2O4-)>c (H+) >c(C2O4-)>c(OH-)。(3)①加入过量的NaOH浓溶液并加热,产生白色沉淀和无色有刺激性气味的气体,可推知Z中含有NH4+;白色沉淀迅速变为灰绿色,最终变为红褐色,可推知Z中含有Fe2+;加入过量的BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,可推知Z中含有SO42-,结合化合物Z(相对分子质量为392),1molZ中含有6mol结晶水,可得Z的化学式为(NH4)2Fe(SO4)2·6H2O。②KMnO4溶液(硫酸酸化)具有强氧化性,把Fe2+氧化成Fe3+,其离子方程式为:5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O。
考点:有机反应 电离平衡 水解反应 化学计算
点评:酸式盐显酸性的,常见的只有这几个:硫酸氢盐、亚硫酸酸氢盐、磷酸二氢盐、草酸氢盐。把这几个记住就行了,其它的都是碱性的。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
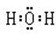
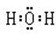
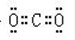
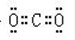

查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)
Ⅰ.(每空1分) 已知某工业废水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。
(1)步骤1需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 。
Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO为SO)
(1)原溶液中肯定存在的离子是 ,肯定没有的离子是 ;
(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响 ;
(3)步骤②中发生反应的离子方程式为 、 .
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市梁山一中高二下学期期中考试化学试卷 (带解析) 题型:填空题
(14分)
【小题1】具有支链的化合物A的分子式为C4H6O2,A可以使溴的四氯化碳溶液退色。1 mol A和1 mol NaHCO3能完全反应,则A的结构简是 。
写出与A具有相同官能团的A的所有同分异构体的结构简式 、
。
【小题2】化合物B含有C、H、O三种元素,相对分子质量为60,其中碳的质量分数为60%,氢的质量分数为13.3%。B在Cu的催化作用下被氧气氧化成C,C能发生银镜反应,则B的结构简式是 。物质B的核磁共振氢谱(NMR)会产生 个吸收峰,峰值比例为 。
【小题3】D是由A和B反应生成的酯,相应反应的化学方程式是______________
查看答案和解析>>
科目:高中化学 来源:2012届云南省建水一中高三9月份月考理科综合试题(化学部分) 题型:填空题
(14分)
Ⅰ.(每空1分) 已知某工业废水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。
(1)步骤1需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 。
Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO为SO)
(1)原溶液中肯定存在的离子是 ,肯定没有的离子是 ;
(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响 ;
(3)步骤②中发生反应的离子方程式为 、 .
查看答案和解析>>
科目:高中化学 来源:2011-2012学年云南省高三9月份月考理科综合试题(化学部分) 题型:填空题
(14分)
Ⅰ.(每空1分) 已知某工业废水中含有大量的CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其他物质。

(1)步骤1需用到的玻璃仪器除烧杯外有 。
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,固体残渣的成分是(填化学式) 。
(3)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干。
(4)步骤2应该在通风橱中进行,原因是 。
Ⅱ.((2)为1分,其余每空2分)某溶液中含有Na+、SO、SO、CO、Cl-、Br-中的若干种,依次进行下列实验,观察到的现象记录如下:①加入盐酸,有无色气体生成;②向原溶液中滴加氯水,无气体产生,再加CCl4振荡,静置,CCl4层呈橙色,用分液漏斗分液;③向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,有白色沉淀生成,过滤;④在滤液中加AgNO3和HNO3的混合液,有白色沉淀产生.试回答:(提示:氯气会氧化SO为SO)
(1)原溶液中肯定存在的离子是 ,肯定没有的离子是 ;
(2)若步骤③改用BaCl2和盐酸的混合溶液,对判断(1)结论有无影响 ;
(3)步骤②中发生反应的离子方程式为 、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com