
【题目】探究铁钉在不同溶液中的腐蚀情况。实验装置与数据如下:
实验装置 | 实验数据 |
|
|
下列说法不正确的是
A.①的负极反应:Fe-3e-=Fe3+
B.③的正极反应:O2+2H2O+4e-=4OH-
C.②可能同时发生析氢腐蚀和吸氧腐蚀
D.金属的电化学腐蚀以哪种类型为主与溶液的pH有关
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2质量计),某研究小组同学设计了如下实验方案:
I.称取样品Wg后加入足量稀硫酸;
II.将I中产生的SO2用足最H2O2溶液吸收;
III.将II所得溶液用0.lmolL-1氢氧化钠溶液滴定,消耗体积为VmL;
IV.数据处理。
下列是小组同学对实验的设计、分析及数据处理,其中正确的是( )
A.步骤I中可用稀硝酸代替稀硫酸
B.1kg样品中含SO2的质量为![]() g
g
C.若用”溴水”替换II中的氧化剂“H2O2溶液”,对测定结果无影响
D.步骤I中生成的SO2残留在装置中未被H2O2溶液吸收,可能导致测得亚硫酸盐含量偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别调节0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系统中微粒浓度的负对数值(-lgc)与pH的关系分别如下图所

下列说法错误的是
A. 25℃时,NH3·H2O![]() NH4++OH-的lgK=-4.7
NH4++OH-的lgK=-4.7
B. 25℃时,0.01mol·L-1HCOOH溶液的pH为3.7
C. HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D. HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c(SO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,在水中存在沉淀溶解平衡:CdS(s)![]() Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
Cd2+(aq)+S2-(aq),其溶度积Ksp=c(Cd2+)·c(S2-),其在水中的沉淀溶解平衡曲线如图所示(T2>T1)。下列说法错误的是( )
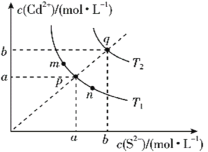
A.T1时CdS在c(S2-)=0.01mol/L的Na2S溶液中,c(Cd2+)=100a2mol/L
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应2SO2(g)+O2(g)2SO3(g)的描述正确的是( )
A.使用催化剂,SO2的平衡转化率增大
B.增大O2浓度,平衡常数K增大
C.当2![]() 正(SO2)=
正(SO2)=![]() 逆(O2)时,反应达到平衡状态
逆(O2)时,反应达到平衡状态
D.升高温度,反应物中活化分子百分数提高,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀是应用电解原理在某些金属表面镀上一薄层其它金属或合金的方法。在铁质铆钉上镀镍(Ni)能防止铁被腐蚀,如图1。实验室模拟铁片镀镍,装置如图2。

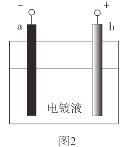
(1)b极材料是__。
(2)电镀液中含有NiSO4、NaCl和硼酸。
已知:NiSO4=Ni2++SO![]() 、Ni2++2H2ONi(OH)2+2H+
、Ni2++2H2ONi(OH)2+2H+
①a极的电极反应式是__。
②硼酸的作用是调节溶液的pH。pH较小时,a极易产生__气体,使镀层疏松多孔。pH较大时,a极会吸附__固体而使镀层含有杂质。
(3)铁质铆钉上镀镍能防止铁被腐蚀是因为镀层使铁与__等物质隔离。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.升高H2SO4稀溶液温度,溶液中c(OH-)增大
B.pH=3的CH3COOH溶液加入CH3COONa固体,溶液的pH减小
C.NaClO稀溶液中加入NaClO固体,溶液中![]() 增大
增大
D.向AgCl、Ag2CrO4的饱和溶液中加入少量AgNO3固体,溶液中![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.24g镁与27g铝中,质子数之比为12∶13
B.相同质量的16O2和18O2,体积比为9∶8
C.将1LCmol·L-1氯化钠溶液加入水中稀释为5L,得到0.2Cmol·L-1氯化钠溶液
D.同温同压时,H2和CH4两种气体的密度之比为1∶8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 已知HI(g) ![]() 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-571.6 kJ·mol-1,则氢气的燃烧热为ΔH=-285.8 kJ·mol-1
C. 已知2C(s)+2O2(g)=2CO2(g) ΔH1, 2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
D. 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com