
【题目】下列有关微粒间作用力的说法正确的是
A. 硼酸[B(OH)3]晶体具有与石墨相似的层状结构,则分子中B原子发生的是sp3杂化,不同层分子间主要作用力是范德华力
B. 金属键可以看作是许多原子共用许多电子所形成的强烈的相互作用,所以与共价键类似也有方向性和饱和性
C. 干冰气化和冰融化克服的分子间作用力相同
D. 离子晶体熔融状态电离过程中,只有离子键被破坏
【答案】D
【解析】
A. 硼酸[B(OH)3]晶体具有与石墨相似的层状结构,则分子中心原子B原子只形成3个σ键,没有孤电子对,故其杂化方式为sp2杂化,不同层分子间主要作用力是范德华力,A错误;
B. 在金属晶体中,自由电子是由金属原子提供的,并且在整个金属内部的三维空间内运动,为整个金属的所有阳离子所共有,故金属键无方向性和饱和性,B错误;
C. 干冰和冰都属于分子晶体,但是冰中含有氢键,所以干冰气化只需要克服分子间作用力,冰融化要克服分子间作用力和氢键,C错误;
D. 离子晶体熔融状态电离过程中,只有离子键被破坏,比如NaHSO4在熔融状态下的电离方程式为:![]() ,D正确;
,D正确;
和合理选项为D。


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:
【题目】已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。
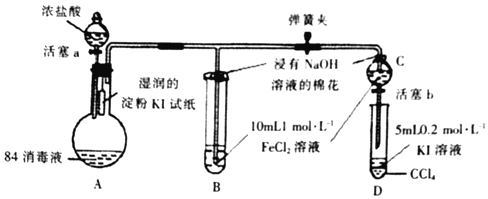
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-硫电池具有高能量密度、续航能力强等特点。使用新型碳材料复合型硫电极的锂-硫电池工作原理示意图如图,下列说法正确的是
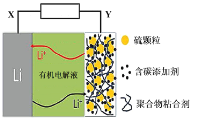
A.电池放电时,X电极发生还原反应
B.电池充电时,Y电极接电源正极
C.电池放电时,电子由锂电极经有机电解液介质流向硫电极
D.向电解液中添加Li2SO4水溶液,可增强导电性,改善性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式正确的是
A.用CuSO4溶液除去乙炔中的H2S:S2-+ Cu2+ = CuS ↓
B.某种火箭发射逸出的N2O4变红棕色:N2O4 ![]() 2NO2
2NO2
C.Na2O2用于呼吸面具供氧:Na2O2+H2O = 2NaOH+O2↑
D.CuSO4溶液中加入过量氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B. 最外层电子数为ns2的元素都在元素周期表第2列
C. 处于最低能量的原子叫做基态原子,1s22s22![]() →1s22s22
→1s22s22![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
D. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着化工产业的迅猛发展,氯化氢转化为氯气的技术成为科学研究的热点。请按要求回答下列问题:
(1)HCl直接氧化法制Cl2可按下列催化过程进行:
CuCl2(s)=CuCl(s)+1/2Cl2(g) ΔH1 = +83 kJ·mol-1
CuCl(s)+1/2O2(g)=CuO(s)+1/2Cl2(g) ΔH2 = -20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3 = -121 kJ·mol-1
写出HCl直接氧化法制Cl2的热化学方程式:____________________________。
(2)在恒定容器中用上述HCl直接氧化法制Cl2,进料c(HCl) ∶c(O2)分别为1:1、4:1、7:1时,HCl平衡转化率随温度变化的关系如下图所示:
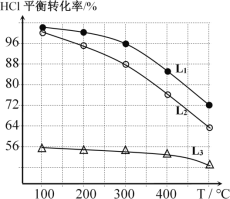
①判断图中c(HCl) /c(O2) = 1:1的曲线为________。
②按化学计量系数比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料时c(HCl)/c(O2)过低、过高的不利影响分别是____________、________。
③综合上述信息,写出在一定温度的条件下进一步提高HCl的转化率的方法: ________________________________________。
④观察上图,以任何一条曲线为例,平衡常数K(200℃)________K(300℃)(填“大于”、“小于”或“等于”)。
⑤设O2初始浓度为c,计算L2对应K(300℃) =____________(列出含c的计算式)。
(3)科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
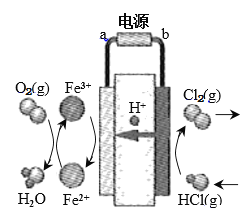
①电源b极为____________极。
②写出阳极区域反应方程式:________________________________________。
③电路中转移1 mol电子时,阳极产生气体体积为__________________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是
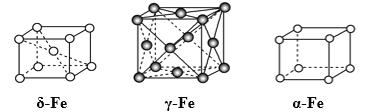
A. δFe晶胞中含有2个铁原子,每个铁原子等距离且最近的铁原子有8个
B. 晶体的空间利用率:δFe > γFe> αFe
C. 设γFe晶胞中铁原子的半径为d,则γFe晶胞的体积是16![]() d 3
d 3
D. 已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1),δFe晶胞的密度为ρ g/cm3,则铁原子的半径r(cm)=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
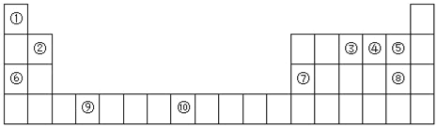
(1)表中属于s区的非金属元素是________(用元素符号表示),元素⑩核外电子排布式为________________,
(2)元素③④⑤电负性由小到大___________(用元素符号表示)
(3)若元素③用R表示,为什么可以形成RCl3分子,不可以形成RCl5分子:____________。
(4)元素⑤与⑧元素相比非金属性较强的是________(写元素名称),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性 B.两元素的电负性
C.单质分子中的键能 D.含氧酸的酸性
E.氢化物中X—H键的键长 F.两单质在自然界中的存在形式
(5)元素⑦的氧化物与元素⑧的最高价氧化物的水化物反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
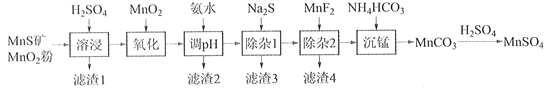
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com