
【题目】氧元素与多种元素具有亲和力,所形成化合物的种类很多。
(1)氮、氧、氟元素的第一电离能从大到小的顺序为______。氧元素与氟元素能形成OF2分子,该分子的空间构型为______
(2)根据等电子体原理,在NO2+中氮原子轨道杂化类型是______;1molO22+中含有的π键数目为______个
(3)氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等。Cr基态核外电子排布式为______
(4)下列物质的分子与O3分子的结构最相似的是______
A.H2O B.CO2 C.SO2 D.BeCl2
(5)O3分子是否为极性分子______
【答案】![]() V形 sp 2NA 1s22s22p63s23p63d54s1(或[Ar]3d54s1) C 是
V形 sp 2NA 1s22s22p63s23p63d54s1(或[Ar]3d54s1) C 是
【解析】
(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素;![]() 分子中O原子价层电子对个数
分子中O原子价层电子对个数![]() ,且含有2个孤电子对;
,且含有2个孤电子对;
(2)NO2+离子中氮原子价层电子对个数![]() ,所以为sp杂化;O22+和N2分子为等电子体,其结构和N2结构相似;
,所以为sp杂化;O22+和N2分子为等电子体,其结构和N2结构相似;
(3)Cr元素的原子序数是24号元素,根据构造原理其核外电子排布式为;
(4)O3分子的结构如图![]() ,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,有一对孤电子对,使O3分子呈V形;
,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,有一对孤电子对,使O3分子呈V形;
(5)O3中的中心O原子为sp2杂化,有两个σ键和一对孤电子对,正负电荷重心不重合,所以是极性分子。
(1)同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素第一电离能大于相邻元素,所以这三种元素第一电离能大小顺序是:![]() ;
;![]() 分子中O原子价层电子对个数
分子中O原子价层电子对个数![]() ,且含有2个孤电子对,所以其空间构型为V形,故答案为:
,且含有2个孤电子对,所以其空间构型为V形,故答案为:![]() ;V形;
;V形;
(2)NO2+离子中氮原子价层电子对个数![]() ,所以为sp杂化;O22+和N2分子为等电子体,其结构和N2结构相似,一个氮气分子中含有2个π键,所以一个O22+中含有两个π键,则1mol O22+中含有的π键数目为2NA;故答案为:sp;2NA;
,所以为sp杂化;O22+和N2分子为等电子体,其结构和N2结构相似,一个氮气分子中含有2个π键,所以一个O22+中含有两个π键,则1mol O22+中含有的π键数目为2NA;故答案为:sp;2NA;
(3)Cr元素的原子序数是24号元素,其原子核外有24个电子,根据构造原理其核外电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(4)O3分子的结构如图![]() ,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,有一对孤电子对,使O3分子呈V形;
,在臭氧O3中,中心的氧原子以sp2杂化,与两旁的配位氧原子键合生成两个σ键,有一对孤电子对,使O3分子呈V形;
A.H2O中含有2对σ键,2对孤电子对,O原子sp3杂化,空间结构为V形,故A错误;
B.CO2为含有2个σ键,没有孤电子对,为sp杂化,空间结构为直线形,故B错误;
C.SO2分子呈“V”字形结构,其成键方式与O3类似,S原子sp2杂化,有一对孤电子对,故C正确;
D.BeCl2含有2个σ键,没有孤电子对,为sp杂化,空间结构为直线形,故D错误,故答案为:C;
(5)O3中的中心O原子为sp2杂化,有两个σ键和一对孤电子对,正负电荷重心不重合,所以是极性分子,故答案为:是。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】在2 L容积不变的容器中,发生N2+3H2 ![]() 2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
2NH3的反应。现通入4 mol H2和4 mol N2,10 s内用H2表示的反应速率为0.12 mol/(L·s),则10 s后容器中N2的物质的量是
A. 1.6 mol B. 2.8 mol
C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)、碲(Te)的单质和化合物在化工生产等方面具有重要应用。
(1)下列关于硒、碲及其化合物的叙述不正确的是_______。
A.Te 位于周期表的第五周期 Ⅵ A 族
B.Se 的氧化物通常有SeO2和SeO3
C.H2TeO4的酸性比H2SO4的酸性强
D.热稳定性H2Se比H2S弱,但比HBr强
(2)25℃ 时,硒酸的电离H2SeO4=H+ +![]() ;
;![]() H+ +
H+ +![]() Ka2 = 1×10-3,则0.1 mol·L-1NaHSeO4溶液的pH约为________;NaHSeO4溶液中的物料守恒表达式为____________。
Ka2 = 1×10-3,则0.1 mol·L-1NaHSeO4溶液的pH约为________;NaHSeO4溶液中的物料守恒表达式为____________。
(3)TeO2微溶于水,易溶于较浓的强酸和强碱。工业上常用铜阳极泥(主要含TeO2,还含有少量Ag、Au)为原料制备单质碲,其工艺流程如图:
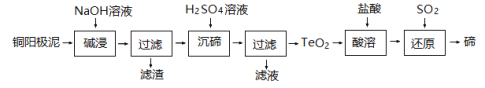
①铜阳极泥在碱浸前需烘干、研成粉末,目的是____________;
②“碱浸”时TeO2发生反应的化学方程式为_____________;
③“沉碲”时控制溶液的 pH 为 4.5~5.0,生成TeO2沉淀,酸性不能过强的原因是__________;
④“还原”得到固态碲为粗碲,对粗碲进行洗涤,判断洗涤干净的实验操作和现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有五种元素X、Y、Z、Q、T。X元素为主族元素,X原子的M层p能级上有两个未成对电子且无空轨道;Y原子的价电子排布为3d64s2;Z原子的L电子层的p能级上有一个空轨道;Q原子的L电子层的P能级上只有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述不正确的是
A.元素Y和Q可形成化合物Y2Q3
B.X与T的最高价氧化物对应的水化物,前者的酸性比后者强
C.X和Q结合生成的化合物为离子化合物
D.ZQ2是极性键构成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家合成了一种新的化合物,其结构式如图所示。该物质中 W、X、Y、Z、M是短周期中常见元素,且原子序数依次增大;已知M元素原子核外电子总数是Y元素原子核外 电子总数的两倍。下列说法中错误的是
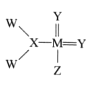
A.由X和Y两种元素形成的化合物有多种
B.W和Z元素位于周期表中同一主族
C.元素的非金属性强弱顺序为:Z>Y>X
D.Y、M元素的气态氢化物沸点高低为:Y>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A. 分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B. NCl3分子是非极性分子
C. NBr3比NCl3易挥发
D. 在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子,则NH3·H2O的结构式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是合成抗病毒药品洛匹那韦的一种重要中间体。其合成路线如下(其中Ph表示苯基):

回答下列问题:
(1)物质A的化学名称是_______________
(2)反应①所需的试剂和条件是 ______________;反应⑤所属的反应类型为__________________
(3)F中含氧官能团的名称是_______________
(4)反应②的化学反应方程式为______________
(5)有机物X是C的同分异构体,写出满足下列条件的X结构简式为_______________
①苯环上有三个取代基
②分子结构中含有硝基
③核磁共振氢谱有4组峰,峰面积之比为6:2:2:1
(6)写出以![]() 和CH3CN为原料,制备
和CH3CN为原料,制备 的合成路线(无机试剂任选)。_______________
的合成路线(无机试剂任选)。_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能实现相应实验目的的是
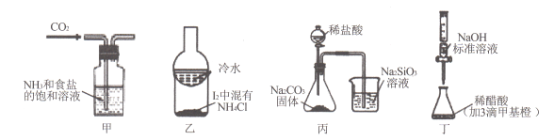
A. 甲用于制取NaHCO3晶体 B. 乙用于分离I2和NH4Cl
C. 丙用于证明非金属性强弱:Cl>C>Si D. 丁用于测定某稀醋酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力,下面是从海带中提取碘单质的流程:
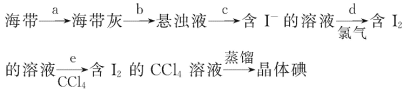
(1)步骤c的操作方法是__________;除漏斗、烧杯外,还需要使用的玻璃仪器是_________。
(2)步骤d所得溶液的颜色为_______,反应的离子方程式为_______________________________。
(3)步骤e中加入CCl4振荡、静置后,液体分为两层,上层液体呈_____色,下层液体呈______色;步骤e的操作方法是_____________,所用的主要实验仪器是___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com