
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为 7.5 7.5 g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器有 托盘天平、药匙 托盘天平、药匙 |
| (3)将KCl放入到100mL烧杯中加水溶解 | 为加快溶解速度,可采取的措施是 搅拌、加热、研细氯化钠等措施 搅拌、加热、研细氯化钠等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是 玻璃棒引流 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水到刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切. 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切. |
| n |
| v |


科目:高中化学 来源: 题型:阅读理解
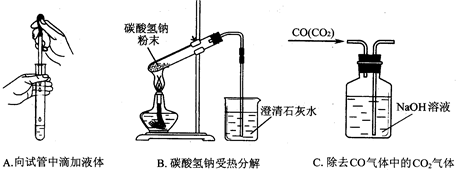
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为 g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器有 |
| (3)将KCl放入到100mL烧杯中加水溶解 | 为加快溶解速度,可采取的措施是 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是 |
| (5)向容量瓶中加蒸馏水到刻度线 | 在进行此操作时应注意的问题是 |
查看答案和解析>>
科目:高中化学 来源: 题型:
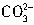 、
、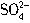 、Cl-离子中的几种。
、Cl-离子中的几种。查看答案和解析>>
科目:高中化学 来源:2010-2011学年海南省乐东县黄流中学高一(上)期中化学试卷(解析版) 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需KCl的质量 | 需要KCl的质量为______g |
| (2)称量KCl固体 | 称量过程中主要用到的仪器有______ |
| (3)将KCl放入到100mL烧杯中加水溶解 | 为加快溶解速度,可采取的措施是______ |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是______ |
| (5)向容量瓶中加蒸馏水到刻度线 | 在进行此操作时应注意的问题是______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com