
| A. | 在标准状况下,22.4LCCl4中含5 NA个原子 | |
| B. | 0.1mol铁与足量的盐酸完全反应,铁失去的电子数为0.1 NA | |
| C. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 NA | |
| D. | 将100mL0.1mol•L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒数目为0.01 NA |
分析 A.标准状况下,四氯化碳的状态不是气态;
B.铁与盐酸反应生成氯化亚铁,0.1mol铁失去0.2mol电子;
C.氧气和臭氧都只含有O元素,1.6g二者混合物中含有1.6gO,根据n=$\frac{m}{M}$计算出含有氧原子的物质的量,再根据N=nNA计算出含有氧原子数;
D.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶体中含有胶粒数目.
解答 解:A.标准状况下,四氯化碳不是气体,不能使用标准状况下的气体摩尔体积计算,故A错误;
B.0.1mol铁与足量的盐酸完全反应生成0.1mol氯化亚铁,铁失去0.2mol电子,失去的电子数为0.2NA,故B错误;
C.1.6g由氧气和臭氧组成的混合物中含有1.6gO原子,含有氧原子的物质的量为:$\frac{1.6g}{16g/mol}$=0.1mol,含有氧原子的数目为0.1 NA,故C正确;
D.由于氢氧化铁胶粒为氢氧化铁的聚集体,则无法计算制得的胶体中含有氢氧化铁胶粒的数目,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标准状况下气体摩尔体积的使用条件,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 容器里气体的密度为40g•L-1 | |
| B. | SO3的分解率为20% | |
| C. | 化学反应速率v(Ag2SO4)=v(SO3) | |
| D. | 在这10min内的平均反应速率为v(O2)=0.005mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
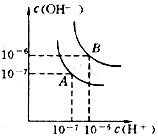 水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点
水的电离平衡线如图所示.若以A点表示25℃时水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑥⑤②①④③ | B. | ⑤⑥②①③④ | C. | ④③②①⑤⑥ | D. | ④③①②⑥⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{{{r}_{N{a}^{+}}}^{\;}}{{r}_{Na}}$ | B. | $\frac{{r}_{Mg}}{{r}_{Na}}$ | C. | $\frac{{r}_{p}}{{r}_{Cl}}$ | D. | $\frac{{r}_{N}}{{r}_{p}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com