
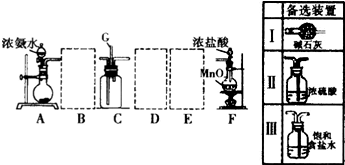
 .
.分析 (1)①利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应;
②根据含有的杂质的性质选择合理的除杂装置,氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,制取的氯气中混有氯化氢气体和水蒸气,水蒸气用饱和食盐水除去,水蒸气用浓硫酸干燥除去;
③氯气和氨气在常温下相混合就会生成氯化铵和氮气,依据原子守恒配平书写化学方程式;
(2)NH3和NO可在一定条件下可反应生成氮气和水,标注元素化合价变化,得到盐酸化合价升高和降低,计算得到电子转移总数,氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目,用双线桥标出;
(3)依据热化学方程式和盖斯定律计算所得热化学方程式,反应自发进行的判断依据是△H-T△S<0;
解答 解:(1)①利用物质溶解时放出热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,
A.浓硫酸和氨水反应不能生成氨气,故A错误;
B.生石灰溶解于水时放出热量,可以生成氨气,故B正确;
C.五氧化二磷虽然溶于水时放热,但是酸性物质,和一水合氨反应,不能生成氨气,故C错误;
D.无水硫酸铜溶解不能升高温度,不能生成氨气,故D错误;
该方法制取NH3的原因生石灰与氨水中的水反应生成Ca(OH)2使氨水变得更浓;放出大量的热,使一水合氨分解:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O;溶液中c(OH-)增大,使平衡NH3+H2O?NH3•H2O?OH-+NH4+向左移动,
故答案为:B,生石灰与氨水中的水反应生成Ca(OH)2使氨水变得更浓;放出大量的热,使一水合氨分解:NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$ NH3↑+H2O;溶液中c(OH-)增大,使平衡NH3+H2O?NH3•H2O?OH-+NH4+向左移动;
②氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ,
故答案为:Ⅰ、Ⅱ、Ⅲ;
③氯气和氨气在常温下相混合就会生成氯化铵和氮气,反应的化学方程式为:8NH3+3Cl2=N2+6NH4Cl,
故答案为:8NH3+3Cl2=N2+6NH4Cl;
(2)在反应6NO+4NH3=5N2+6H2O中,化合价变化的只有氮元素,一氧化氮中氮元素化合价由+2价降为0价,氨气中氮元素化合价由-3价升为0价,反应转移电子12mol,即 ,
,
故答案为: ;
;
(3)①NH4Cl(s)=NH3(g)+HCl(g)△H=+163.9kJ•mol-1
②HCl(g)+CH3OH(g)→CH3Cl(g)+H2O(g)△H=-31.9kJ•mol-1
盖斯定律计算①+②得到氯化铵和甲醇反应的热化学方程式为:NH4Cl(s)+CH3OH(g)→NH3(g)+CH3Cl(g)+H2O(g)△H=+132 kJ•mol-1,该反应△H>0,满足
△H-T△S<0,则△S>0,
故答案为:NH4Cl(s)+CH3OH(g)→NH3(g)+CH3Cl(g)+H2O(g)△H=+132 kJ•mol-1 ,△S>0;
点评 本题考查了氨气和氯气的制取及性质,氧化还原反应电子转移标注,涉及了装置选择、化学方程式书写、尾气处理等知识,注意干燥管干燥氨气时是大口进去小口出气,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 生成物是HI和HClO | B. | 生成物是HCl和HIO | ||
| C. | 属于置换反应 | D. | 属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 25℃时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| C. | 在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5 mol/L,则此时v(正)>v(逆) | |
| D. | 80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质燃烧总是放热的 | |
| B. | 放热反应在反应发生时都不需要加热 | |
| C. | 热化学方程式中,化学式前的化学计量数仅表示物质的量 | |
| D. | 大多数化合反应是放热的,大多数分解反应是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  玛瑙 | B. |  光导纤维 | C. |  太阳能电池板 | D. |  水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 没有氧元素参加的反应一定不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯和硝酸混和,再加入浓硫酸,冷却 | |
| B. | 先加苯,再加浓硫酸,最后加入浓硝酸 | |
| C. | 在浓硝酸中加入浓硫酸,冷却后加入苯 | |
| D. | 在浓硫酸中加入浓硝酸,冷却后加入苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(气)+O2(气)═2H2O(气)△H1 2H2(气)+O2(气)═2H2O(液)△H2 | |
| B. | S(气)+O2(气)═SO2(气)△H1 S(固)+O2(气)═SO2(气)△H2 | |
| C. | C(固)+O2(气)═CO2(气)△H1 C(固)+$\frac{1}{2}$O2 (气)═CO(气)△H2 | |
| D. | H2(气)+Cl2(气)═2HCl(气)△H1 $\frac{1}{2}$H2(气)+$\frac{1}{2}$ Cl2(气)═HCl(气)△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
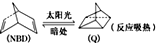 ,下列叙述中错误的是( )
,下列叙述中错误的是( )| A. | Q的能量高于NBD | B. | NBD和Q的分子式不同 | ||
| C. | Q的一氯代物只有3种 | D. | NBD的同分异构体可以是芳香烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com