
用NA表示阿伏伽德罗常数的值,下列有关说法正确的是
A. 标准状况下,33.6LHF中含有氟原子的数目为1.5NA
B. 1.0L 1.0mol·L-1Na2SO4水溶液中含有的氧原子数为4NA
C. 电解饱和食盐水,当阴极产生1.12LH2时,转移的电子数为0.1NA
D. 常温下,2L0.1mol·L-1FeCl3溶液与1L0.2mol·L-1FeCl3溶液所含Fe3+数目不同
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列化合物中,可以通过置换反应一步得到的是( )
①FeSO4 ②NaOH ③Fe3O4 ④Al2O3
A. ①②③④ B. ①②③ C. ①④ D. ①③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
用蘸有浓氨水的棉棒检漏输氯管道的原理为:3Cl2+8NH3=N2+6NH4Cl。该反应的下列说法正确的是( )
A. 35.5 g氯气所含的分子数为6.02×1023
B. 常温常压下,22.4 L氨气所含原子总数为4×6.02×1023
C. 反应每生成1 mol N2转移电子数约为6×6.02× 1023
D. 1 mol·L-1 NH4Cl溶液中,含有Cl-数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省盐城市高二学业水平模拟(一)化学试卷(解析版) 题型:选择题
我国首飞的长征七号运载火箭采用液氧和煤油作为推进剂。煤油属于( )

A. 纯净物 B. 混合物 C. 氧化物 D. 单质
查看答案和解析>>
科目:高中化学 来源:2017届湖北省黄冈市高三第三次联考理综化学试卷(解析版) 题型:选择题
X、Y、Z、W、R为原子序数依次增大的五种短周期主族元素。X原子的最外层电子数是其内层电子数的2倍,W+与Y2-具有相同的电子层结构,R与Y可形成RY2、RY3化合物。下列说法正确的是
A. Y与氢元素所形成的化合物分子只含有极性键
B. W2Y、W2Y2中阴、阳离子个数比均为1:2
C. Z的最高价氧化物对应水化物的酸性比R的强
D. 将XY2通入W单质与水反应后的溶液中,生成的盐只有一种
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳、信阳等六市高三第一次联考理综化学试卷(解析版) 题型:简答题
为有效控制雾霾,各地积极采取措施改善大气质量,有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内按照催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g)+2CO(g)=N2(g)+2CO2(g)) △H=_______kJ·mol-1
(2)将0.20molNO和0.10molCO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
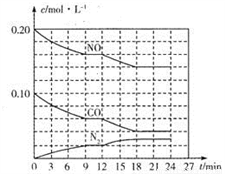
①CO在0-9min内的平均反应速率v(CO)=________mol·L-1·min-1 (保留两位有效数字);第12 min时改变的反应条件可能为________。
A.升高温度 B.加入NO C.加催化剂 D.降低温度
②该反应在第18 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1mol·L-2的
HCOONa溶液pH=10,则HCOOH的电离常数Ka=______________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省南阳、信阳等六市高三第一次联考理综化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol甲基中含有电子数为10NA
B. 常温下,1LpH=12的Na2CO3溶液中含有的OH-离子数为0.01 NA
C. 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA
D. 50mL12mol·L-1盐酸和足量MnO2共热,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源:2017届江苏省常州市高三第一次模拟考试化学试卷(解析版) 题型:填空题
碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂。为确定碱式次氯酸镁的组成,进行如下实验:
① 准确称取1.685g碱式次氯酸镁试样于250mL锥形瓶中,加入过量的KI溶液,用足量乙酸酸化,用O.8000mol/LNa2S2O3标准溶液滴定至终点(离子方程式为2S2O32-+I2=2I-+S4O62-),消耗25.00mL。
② 另取1.685g碱式次氯酸镁试样,用足量乙酸酸化,再用足量3%H2O2溶液处理至不再产生气泡(H2O2被ClO-氧化为O2),稀释至1000mL。移取25.00mL溶液至锥形瓶中,在一定条件下用0.020 00mol/L EDTA(Na2H2Y)标准溶液滴定其中的Mg2+(离子方程式为Mg2++H2Y2-=MgY2-+2H+) ,消耗25.00 mL
(1)步骤① 中需要用到的指示剂是_______。
(2)步骤② 中若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将____(填“偏高”、“偏低”或“不变”)。
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程)。____
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省济南市高一下学期开学考试化学试卷(解析版) 题型:选择题
下列关于元素周期表和元素周期律的说法错误的是( )
A. Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B. 第二周期元素从Li到F,非金属性逐渐增强
C. 因为Na比K容易失去电子,所以Na比K的还原性强
D. O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com