
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
| KMnO4酸性溶液 的浓度/mol?L-1 |
溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. |
反应快慢:Mg>Fe>Cu | 反应物的性质越活泼,反应速度越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. |
反应快慢: Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快. |
查看答案和解析>>
科目:高中化学 来源: 题型:
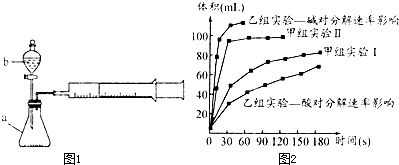
| 实验序号 | 实验目的 | T/K | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 做实验参照 | 298 | 3滴FeCl3溶液 | 10mL2%H2O2 |
| 甲组实验Ⅱ | 298 | 10mL5%H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com