
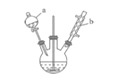
【题目】苯甲醛是一种重要的化工原料,某小组同学利用如图所示实验装置(夹持装置已略去)制备苯甲醛。
已知有机物的相关数据如下表所示:
有机物 | 沸点℃ | 密度为g/cm3 | 相对分子质量 | 溶解性 |
苯甲醛 | 178.1 | 1.04 | 106 | 微溶于水,易溶于乙醇、醚和卤代烃 |
苯甲醇 | 205.7 | 1.04 | 108 | 微溶于水,易溶于乙醇、醚和卤代烃 |
二氯甲烷 | 39.8 | 1.33 | 难溶于水,易溶于有机溶剂 |
实验步骤:
①向容积为500mL的三颈烧瓶加入90.0mL质量分数为5%的次氯酸钠溶液(稍过量),调节溶液的pH为9-10后,加入3.0mL苯甲醇、75.0mL二氯甲烷,不断搅拌。
②充分反应后,用二氯甲烷萃取水相3次,并将有机相合并。
③向所得有机相中加入无水硫酸镁,过滤,得到有机混合物。
④蒸馏有机混合物,得到2.08g苯甲醛产品。
请回答下列问题:
(1)仪器b的名称为______,搅拌器的作用是______。
(2)苯甲醇与NaClO反应的化学方程式为_______。
(3)步骤①中,投料时,次氯酸钠不能过量太多,原因是____;步骤③中加入无水硫酸镁,若省略该操作, 可能造成的后果是______。
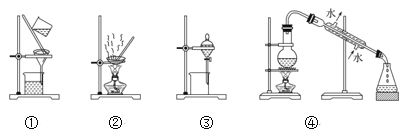
(4)步骤②中,应选用的实验装置是___(填序号),该操作中分离出有机相的具体操作方法是___。
(5)步骤④中,蒸馏温度应控制在_______左右。
(6)本实验中,苯甲醛的产率为________(保留到小数点后一位)。
【答案】球形冷凝管 使物质充分混合 ![]() + NaClO→
+ NaClO→![]() + NaCl+H2O 防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 产品中混有水,纯度降低 ③ 打开分液漏斗颈部的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯壁流下,当有机层恰好全部放出时,迅速关闭活塞 178.1℃ 67.9%
+ NaCl+H2O 防止苯甲醛被氧化为苯甲酸,使产品的纯度降低 产品中混有水,纯度降低 ③ 打开分液漏斗颈部的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯壁流下,当有机层恰好全部放出时,迅速关闭活塞 178.1℃ 67.9%
【解析】
(1)根据图示结合常见的仪器的形状解答;搅拌器可以使物质充分混合,反应更充分;
(2)根据实验目的,苯甲醇与NaClO反应生成苯甲醛;
(3)次氯酸钠具有强氧化性,除了能够氧化苯甲醇,也能将苯甲醛氧化;步骤③中加入无水硫酸镁的目的是除去少量的水;
(4)步骤②中萃取后要进行分液,结合实验的基本操作分析解答;
(5)步骤④是将苯甲醛蒸馏出来;
(6) 首先计算3.0mL苯甲醇的物质的量,再根据反应的方程式计算理论上生成苯甲醛的质量,最后计算苯甲醛的产率。
(1)根据图示,仪器b为球形冷凝管,搅拌器可以使物质充分混合,反应更充分,故答案为:球形冷凝管;使物质充分混合;
(2)根据题意,苯甲醇与NaClO反应,苯甲醇被氧化生成苯甲醛,次氯酸钠本身被还原为氯化钠,反应的化学方程式为![]() + NaClO→
+ NaClO→![]() + NaCl+H2O,故答案为:
+ NaCl+H2O,故答案为:![]() + NaClO→
+ NaClO→![]() + NaCl+H2O;
+ NaCl+H2O;
(3)次氯酸钠具有强氧化性,除了能够氧化苯甲醇,也能将苯甲醛氧化,因此步骤①中,投料时,次氯酸钠不能过量太多;步骤③中加入无水硫酸镁的目的是除去少量的水,提高产品的纯度,若省略该操作,产品中混有水,纯度降低,故答案为:防止苯甲醛被氧化为苯甲酸,使产品的纯度降低;产品中混有水,纯度降低;
(4)步骤②中,充分反应后,用二氯甲烷萃取水相3次,萃取应该选用分液漏斗进行分液,应选用的实验装置是③,分液中分离出有机相的具体操作方法为打开分液漏斗颈部的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯壁流下,当有机层恰好全部放出时,迅速关闭活塞,故答案为:③;打开分液漏斗颈部的玻璃塞(或使玻璃塞上的凹槽对准分液漏斗上的小孔),再打开分液漏斗下面的活塞,使下层液体慢慢沿烧杯壁流下,当有机层恰好全部放出时,迅速关闭活塞;
(5)根据相关有机物的数据可知,步骤④是将苯甲醛蒸馏出来,蒸馏温度应控制在178.1℃左右,故答案为:178.1℃;
(6)根据![]() + NaClO→
+ NaClO→![]() + NaCl+H2O可知,1mol苯甲醇理论上生成1mol苯甲醛,则3.0mL苯甲醇的质量为1.04 g/cm3×3.0cm3=3.12g,物质的量为
+ NaCl+H2O可知,1mol苯甲醇理论上生成1mol苯甲醛,则3.0mL苯甲醇的质量为1.04 g/cm3×3.0cm3=3.12g,物质的量为![]() ,则理论上生成苯甲醛的质量为
,则理论上生成苯甲醛的质量为![]() ×106g/mol=3.06g,苯甲醛的产率=
×106g/mol=3.06g,苯甲醛的产率=![]() ×100%=67.9%,故答案为:67.9%。
×100%=67.9%,故答案为:67.9%。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。
下列有关麦考酚酸说法正确的是( )

A.在一定条件下可与氢气发生加成反应,最多消耗氢气5 mol
B.不能与FeCl3溶液发生显色反应
C.在一定条件下可发生氧化、还原、取代、消去反应
D.1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料,它们以各自的特点满足着人类多方面的需要。
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于_______变化,钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择_______(选填“铜块”、“锌块”、“铅块”);
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产流程如下:

请回答下列问题:
①硝酸钙与碳酸铵在溶液中反应,其基本反应类型为_______;
②实验室常采用_______操作进行沉淀分离;
③生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是_______;
④高纯氧化钙生产过程中,“干燥”的主要目的是为了防止______(用化学方程式表示);
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫塑料,“玉米塑料”的使用可减少_______污染,20世纪30年代,尼龙因其抽成细丝极像蚕丝而被推向世界,生活中可采用______方法区分尼龙和蚕丝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应2SO2(g)+O2(g)![]() 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应至正、逆反应速率相等时,可能存在的数据是( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol·L-1、0.1mol·L-1、0.2mol·L-1,当反应至正、逆反应速率相等时,可能存在的数据是( )
A.SO2为0.4mol·L-1、O2为0.2mol·L-1B.SO2为0.25mol·L-1
C.SO2、SO3均为0.15mol·L-1D.SO3为0.4mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成NH3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL某浓度的氨水中逐滴加入0.01mol/L的盐酸溶液,曲线如图所示,有关粒子浓度关系正确的是()
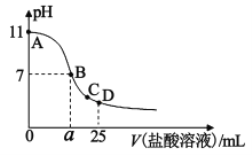
A.该氨水的浓度为0.001mol/L
B.在B点:a=12.5,且有c(NH4+)=c(Cl)=c(OH)=c(H+)
C.在C点:c(Cl)>c(NH4+)>c(H+)>c(OH)
D.在D点:c(NH4+)+c(NH3·H2O)=c(Cl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是化工合成中的重要原料,某化学小组以丙烯为初始原料制备某药物的中间体F,其合成路线如下图所示(部分产物及反应条件已经略去)。
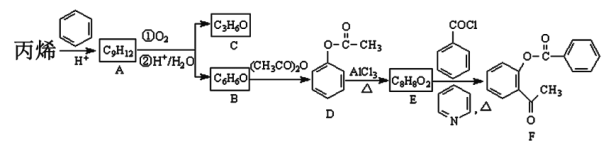
(1)C不能使溴水褪色,核磁共振氢谱显示C中只有一类氢,则C的名称为_______,F中官能团名称为_______
(2)B能与氯化铁溶液发生显色反应,则由B生成D的反应类型为_______,反应的化学方程式为_______,已知A中有五种不同化学环境的氢,试写出由丙烯生成A的化学方程式为_______。
(3)D的同分异构体有多种,其中属于芳香族化合物、且与D同类的异构体,除D外还有_______种,其中能发生银镜反应,且核磁共振氢谱有四个峰的同分异构体的结构简式为_______。
(4)参照上述合成路线结合下面给出的信息,利用![]() 为初始原料设计合成
为初始原料设计合成![]() 的路线_______。已知:
的路线_______。已知:![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜是我国著名科学家,1933年出版《纯碱制造》一书,创立了中国自己的制碱工艺。其纯碱制造原理如下图所示:

(1)由NaHCO3制备纯碱的化学方程式是_________________。
(2)过程Ⅰ通入NH3和CO2的顺序是__________________。
(3)过程Ⅱ析出NH4Cl(s)的原因是_____________。
(4)充分利用副产品NH4Cl生产NH3和HCl。直接加热分解NH4Cl,NH3和HCl的产率往往很低,原因是________________。
(5)采用MgO循环分解NH4Cl。加热,在300℃以下获得NH3;继续加热至350℃~600℃获得HCl气体。利用下列装置(加热及加持装置略)可测量NH3和HCl的产率。

① 低于300℃时,干燥管盛装的干燥剂是_________。NH3吸收完全后,更换干燥剂和吸收装置中的吸收液。
② 产生NH3的化学反应方程式是_________________。
③ 在350℃~600℃,上图虚线框内应选择的安全瓶是________。

④ MgO可以循环分解NH4Cl制得NH3和HCl的原因是____________(结合化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐是___(填化学式)。
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
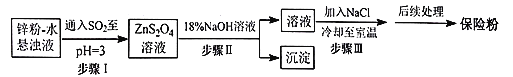
①工业上常将锌块进行预处理得到锌粉-水悬浊液,其目的是__。
②步骤Ⅰ中发生反应的化学方程式为__。
③在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是__,“后续处理”最终要加入少量的Na2CO3固体,其原因是__。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是___。
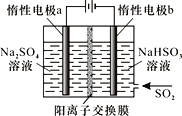
(4)有人设计了图示方法同时制备连二亚硫酸钠和过二硫酸钠(Na2S2O8),并获得中国专利。电解过程中,阴极室生成Na2S2O4,a极的电极反应式为__,通过阳离子交换膜的离子主要是Na+,其迁移方向是__(填“a到b”或“b到a”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com