
分析 水溶液中或熔融状态下能够导电的化合物称为电解质,包括酸、碱、盐都是电解质;
可溶性电解质和能够与水反应生成可溶性电解质的物质,溶于水后能够导电.
解答 解:①NaCl晶体溶于水或者熔化时能电离出自由离子而导电,属于电解质;水溶液能导电;
②液态SO3本身不能电离,不是电解质;SO3与水反应生成硫酸是可溶性的电解质,水溶液导电;
③液态的醋酸溶于水时能电离出自由离子而导电,属于电解质;水溶液能导电;
④汞是金属单质,不是电解质,不溶于水;水溶液能导电;
⑤BaSO4固体熔化时能电离出自由离子而导电,属于电解质;难溶于水,水溶液不导电;
⑥纯蔗糖(C12H22O11)本身不能电离,是非电解质;水溶液不导电;
⑦酒精(C2H5OH)溶于水和熔化时都不导电,不是电解质;水溶液不导电;
⑧熔化的KNO3溶于水或者熔化时能电离出自由离子而导电,属于电解质;水溶液能导电;
(1)以上物质中属于电解质的是 ①③⑤⑧;故答案为:①③⑤⑧;
(2)以上物质中溶于水后形成的水溶液能导电的是 ①②③⑧,故答案为:①②③⑧.
点评 本题考查了电解质的判断,判断电解质时应注意抓住概念的内涵,电解质必须是化合物,必须本身能电离.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
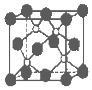 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )| A. | 磷化硼晶体的化学式为BP,属于离子晶体 | |
| B. | 磷化硼晶体的熔点高,且熔融状态下能导电 | |
| C. | 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 | |
| D. | 磷化硼晶体中每个原子均形成4个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
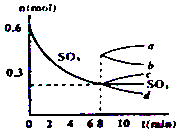 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g);△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、CO32- | B. | Na+、HCO3- | C. | CO32-、HCO3- | D. | Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| B. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| C. | 硫具有还原性,可用硫粉覆盖地上洒落的汞 | |
| D. | 硅是重要的半导体材料,常用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH═CH-CHO | B. | 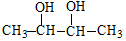 | ||
| C. | HOCH2-CH2-CH═CH-CHO | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
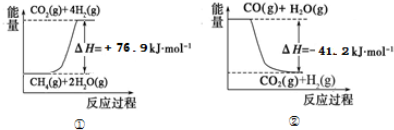
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com