
下列物质性质的变化规律,与共价键键能大小有关的是 ( )
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅 ④NaF、NaCl、NaBr、NaI的熔点依次降低
A. 仅③ B.①③ C. ②③ D.②③④
科目:高中化学 来源: 题型:
 乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是
乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是
A.化学式为C6H6O6
B.乌头酸能发生水解反应和加成反应
C.乌头酸能使酸性高锰酸钾溶液褪色
D.含l mol乌头酸的溶液最多可消耗3 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
不能作为判断硫、氯两种元素非金属性强弱的依据是 ( )
A. 单质氧化性的强弱 B. 氢化物沸点的高低
C. 氢化物还原性强弱 D. 最高价氧化物对应的水化物酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关性质的比较,不能用元素周期律解释的是 ( )
A、酸性:H2SO4>H3PO4 B、非金属性:Cl>Br
C、碱性:NaOH>Mg(OH)2 D、热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如右图所示。下列说法正确的是 ( )
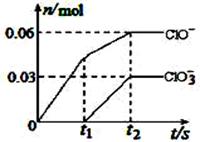
A.苛性钾溶液中KOH的物质的量是0.09mol
B.ClO3-的生成是由于氯气的量的多少引起的
C.在酸性条件下ClO-和ClO3-可生成Cl2
D.反应中转移电子的物质的量是0.21mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知适当条件下+7、+6、+4价锰的化合物都能和浓盐酸反应制得氯气且还原产物都是MnCl2。将6.32g KMnO4粉末加热一段时间后收集到0.112L气体(标准状况,后同),冷却后放入足量的浓盐酸再加热,又收集到VL黄绿色气体,下列说法正确的是 ( )
A.V=2.24L
B.参加反应的HCl为0.18mol
C.无法确定最终生成含钾化合物的数量是多少
D.6.32g KMnO4粉末若直接与足量浓盐酸反应可得到2.24L Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数的值,下列关于0.2mol·L-1的Ba(NO3)2溶液的说法不正确的是
A.2L溶液中有阴、阳离子总数为1.2NA
B.500mL溶液中NO3-离子浓度为0.2mol·L-1
C.500mL溶液中Ba2+离子浓度为0.2mol·L-1
D.500mL溶液中NO3-离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是( )
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱 ②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化 ④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
A.①②③④ B.①③④⑤ C.②④⑤ D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com