
| A. | 原子半径:N>O>F | B. | 酸性强弱:H2SO4>H2SiO3>H2CO3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2 | D. | 氢化物的稳定性:HF>HCl>H2S |
分析 A.同周期,从左向右原子半径减小;
B.非金属性越强,对应最高价氧化物水化物的酸性越强;
C.同周期,从左向右金属性减弱;同主族从上到下金属性增强,金属性越强,对应最高价氧化物水化物的碱性越强;
D.非金属性越强,氢化物越稳定.
解答 解:A.同周期,从左向右原子半径减小,则原子半径为N>O>F,故A正确;
B.非金属性越强,对应最高价氧化物水化物的酸性越强,则酸性为H2SO4>H2CO3>H2SiO3,故B错误;
C.同周期,从左向右金属性减弱;同主族从上到下金属性增强,金属性越强,对应最高价氧化物水化物的碱性越强,则碱性为KOH>NaOH>Mg(OH)2,故C正确;
D.非金属性越强,氢化物越稳定,则氢化物的稳定性为HF>HCl>H2S,故D正确;
故选B.
点评 本题考查元素周期表和周期律的应用,为高频考点,把握元素的位置、性质及元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
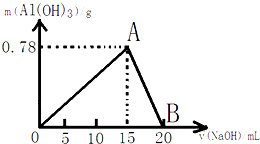
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH3和CH3-CH2-CH3 | B. | CH2=CH2和CH3-CH3 | ||
| C. | CH3-OH和CH3-CH3 | D. | CH4和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开化学键的过程会放出能量 | |
| B. | 放热反应中,反应物的总能量大于生成物的总能量 | |
| C. | 加热才能发生的反应一定是吸热反应 | |
| D. | 化合反应均为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动 | |
| B. | 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验 | |
| C. | 乙醇中含有少量水不能用金属钠除去 | |
| D. | 试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H8的有机物可能存在4个C-C单键 | |
| B. | 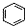 、 、 和 和 均属于芳香烃 均属于芳香烃 | |
| C. |  和 和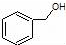 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 结构简式为C2H5-OH的核磁共振氢谱上有2个吸收峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解过程中阴极质量不断减少 | |
| B. | 电解过程中溶液的pH不断升高 | |
| C. | 此时向溶液中加入适量的Ag2O固体可使溶液恢复电解前的状况 | |
| D. | 电解后两极产生的气体体积比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
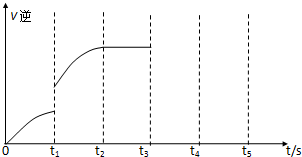
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com