
分析 醋酸钠溶液中醋酸根离子水解,溶液显碱性,加水稀释促进水解,平衡正向进行,氢氧化钠为强碱溶液,醋酸钠为强碱弱酸盐,加热后氢氧化钠溶液的pH基本不变,而醋酸钠的水解程度增大,溶液pH增大.
解答 解:pH=13的CH3COONa溶液加水稀释100倍后,如果没有水解平衡,PH值会变化2个单位,但醋酸根离子存在水解平衡:CH3COO-+H2O?CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,氢氧根离子浓度略有增大,则溶液的pH>11;
pH相等的NaOH溶液与CH3COONa溶液,醋酸钠为强碱弱酸盐,醋酸根离子水解溶液显示碱性,加热后醋酸根离子的水解程度增大,则溶液pH增大,所以分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH,
故答案为:>;加水稀释使平衡CH3COO-+H2O?CH3COOH+OH-右移,氢氧根离子浓度略有增大;>.
点评 本题考查了盐类水解的原理分析应用,掌握基础是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:N>O>F | B. | 酸性强弱:H2SO4>H2SiO3>H2CO3 | ||
| C. | 碱性强弱:KOH>NaOH>Mg(OH)2 | D. | 氢化物的稳定性:HF>HCl>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
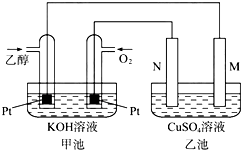
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2晶体中的化学键是离子键 | |
| B. | 某物质在熔融态能导电,则该物质中一定含有离子键 | |
| C. | H2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构 | |
| D. | 干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:O>N | B. | 水溶性:CH3CH2OH>CH3OCH3 | ||
| C. | 沸点:H2S>H2O | D. | 晶格能:NaCl>MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
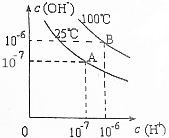
| A. | 25℃时,0.1mol/LNaOH溶液与0.1mol/L乙酸溶液等体积混合,所得溶液的pH等于7 | |
| B. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH小于7 | |
| C. | 100℃时,pH=12的NaOH溶液aL和pH=2的H2SO4溶液bL恰好中和,则a:b=1:1 | |
| D. | 100℃时,pH=12的NaOH溶液和pH=9的NaOH溶液等体积混合,所得溶液的pH约为11.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com