


科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
| ______ | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
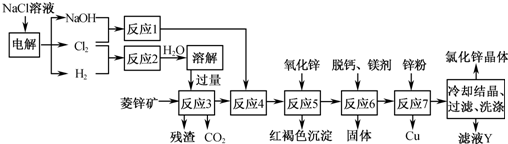
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g?mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.25 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.25 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com