
【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是( )
A.由2Cu + O2 = 2CuO可推出同族的硫也有Cu + S = CuS
B.Fe3O4可表示为FeO·Fe2O3,则Pb3O4可表示为PbO·Pb2O3
C.Mg能在CO2中燃烧,所以Na也能在CO2中燃烧
D.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2
科目:高中化学 来源: 题型:
【题目】废铅蓄电池的一种回收利用工艺流程如图所示:
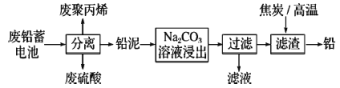
部分难溶电解质的性质如下表:

请回答下列问题:
(1)铅蓄电池在生产、生活中使用广泛,铅蓄电池的缺点有___(写一条)。
(2)利用废铅蓄电池中的废硫酸与氟磷灰石[Ca5(PO4)3F]反应,可以制化肥-过磷酸钙[有效成分是Ca(H2PO4)2],写出该反应的化学方程式:___。
(3)Na2CO3溶液浸出时发生的反应为CO32-(aq)十PbSO4(s)![]() PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=___。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程:___。
PbCO3(s)+SO42-(aq),计算该反应的平衡常数K=___。以滤渣PbCO3和焦炭为原料可制备金属铅,用化学方程式表示制备过程:___。
(4)利用铅泥中PbSO4制取PbO2的方法:PbSO4溶于CH3COONa溶液生成弱电解质(CH3COO)2Pb,(CH3COO)2Pb与KClO在强碱性条件下反应制取PbO2,写出生成PbO2的离子方程式:___。
(5)已知Pb(OH)2是既能溶于稀硝酸又能溶于KOH溶液的两性氢氧化物。设计实验区别PbCrO4和BaCrO4:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向a L密闭容器中加入1 mol O2和2 mol NO,发生如下反应:O2(g)+2NO(g)![]() 2NO2(g),表明此反应不一定达平衡的是( )
2NO2(g),表明此反应不一定达平衡的是( )
A.容器内O2、NO、NO2的浓度之比为1∶2∶2
B.容器内压强不随时间变化
C.容器内各物质的浓度不随时间变化
D.单位时间内生成1 mol O2,同时生成2 mol NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NO2装入带有活塞的密闭容器中,当反应2NO2(g)![]() N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
N2O4(g)达到平衡后,改变下列一个条件,下列叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向正反应方向移动,混合气体的颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入稀有气体,压强增大,平衡向正反应方向移动,混合气体的颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子的最外层电子数是其内层的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且元素Y的基态原子核外电子p电子比s电子多5个。
(1)Z的基态原子的核外电子排布式为_____________。
(2)Z的氧化物是石油化工中重要的催化剂之一,如催化异丙苯()裂化生成苯和丙烯。
①1 mol丙烯分子中含有σ键与π键数目之比为_____________。
②苯分子中碳原子的杂化轨道类型为_____________。
③Z的一种氧化物ZO5中,Z的化合价为+6价,则其中过氧键的数目为_________个。

(3)W、X、Y三种元素的电负性由小到大的顺序为_______(请用元素符号回答)。
(4)ZY3的熔点为1 152 ℃,其在熔融状态下能够导电,据此可判断ZY3晶体属于_________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图所示,每个Z原子周围最近的X原子数目为________。若该化合物的相对分子质量为M,晶胞边长为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_____________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某物质的溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
B. 相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
C. 物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-)
D. AgCl悬浊液中存在平衡: AgCl(s) ![]() Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
Ag+(aq)+Cl-(aq),往其中加入少量 NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光伏材料是指能将太阳能直接转换成电能的材料。光伏材料又称太阳能材料,只有半导体材料具有这种功能。可做太阳电池材料的有单晶硅、多晶硅、非晶硅、GaAs、GaAlAs、InP、CdS、CdTe、CuInSe等。
(1)已知Se在周期表的位置为_____,硅的基态原子电子排布式为_____,基态Ga原子核外电子占据的最高能级为_____,铜的基态原子价电子排布图为_____。
(2)P、S、Ga电负性从大到小的顺序为_____。
(3)与Al元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质,[B(OH)4]-的结构式为____(标出配位键)
(4)已知[Cu(H2O)4]2+具有对称的空间构型,[Cu(H2O)4]2+中的2个H2O被Cl-取代,能得到2种不同结构的产物,则[Cu(H2O)4]2+的空间构型为_____。
(5)As元素的第一电离能____Se元素的第一电离能(填“大于”、“小于”或“等于”),原因是__________。
(6)太阳电池材料的很多金属或金属化合物在灼烧时会产生特殊的火焰颜色,请用原子结构的知识阐述产生此现象的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年2月,江苏镇江自来水出现异味,引发镇江及位于其下游的南通等地区发生居民抢购瓶装饮用水的现象。经初步调查,韩国籍船舶“格洛里亚”号货轮水下排放管道排出的苯酚是引起自来水异味的主要原因。请完成以下填空:
(1)苯酚与水混合,溶液变浑浊,向该浑浊液中滴加NaOH溶液,可观察到的现象是____,向上述反应液中继续通入过量CO2,又可观察到的现象是____,则通入CO2时的反应为_____,说明苯酚具有_______性。
(2)A和B两种物质的分子式都是C7H8O,它们都能跟金属钠反应放出氢气。B能使适量溴水褪色,并产生白色沉淀,A不能。B苯环上的一溴代物有两种。
①写出A和B的结构简式:A________,B_______________。
②写出B与NaOH溶液反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)纯品为棱形结晶,溶于硫酸,遇水易分解,常用于制染料。SO2和浓硝酸在浓硫酸存在时可制备NOSO4H,反应原理为:SO2 + HNO3 = SO3 + HNO2、SO3 + HNO2 = NOSO4H。
(1)亚硝酰硫酸(NOSO4H)的制备。
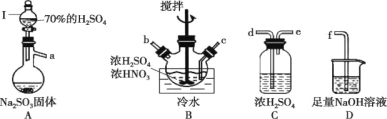
①仪器I的名称为______________,打开其旋塞后发现液体不下滴,可能的原因是_________________。
②按气流从左到右的顺序,上述仪器的连接顺序为__________________(填仪器接口字母,部分仪器可重复使用)。
③A中反应的方程式为___________。
④B中“冷水”的温度一般控制在20℃,温度不宜过高或过低的原因为________。
(2)亚硝酰硫酸(NOSO4H)纯度的测定。
称取1.500 g产品放入250 mL的碘量瓶中,并加入100.00 mL浓度为0.1000 mol·L-1的KMnO4标准溶液和10 mL 25%的H2SO4,摇匀;用0.5000 mol·L-1的Na2C2O4标准溶液滴定,滴定前读数1.02 mL, 到达滴定终点时读数为31.02 mL。
已知:i:□KMnO4 + □NOSO4H + □______ = □K2SO4 + □MnSO4 + □HNO3 + □H2SO4
ii:2KMnO4 + 5Na2C2O4 + 8H2SO4 = 2MnSO4 +10CO2↑+ 8H2O
①完成反应i的化学方程式:_____________
□KMnO4 + □NOSO4H + □______ = □K2SO4 + □MnSO4 + □HNO3 + □H2SO4
②滴定终点的现象为____________________。
③产品的纯度为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com