
【题目】利用如图装置可以进行实验并能达到实验目的的是
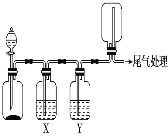
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
D | 用CaO与浓氨水制取并收集纯净干燥的NH3 | NaOH溶液 | 碱石灰 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴的流程如下:
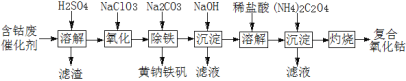
(1)用H2SO4溶解后过滤,得到的滤渣是____(填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是____。
(2)在加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,反应的离子方程式是____。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]。
3Fe2++2[Fe(CN)6]3 =Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4 =Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是____。(仅供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(4)向氧化后的溶液中加入适量的Na2CO3调节酸度,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的离子方程式:____。
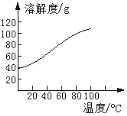
(5)已知CoCl2的溶解度曲线如图所示。向碱式碳酸钴沉淀中加入足量稀盐酸边加热边搅拌至完全溶解后,需趁热过滤的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 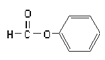 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。当向其中加入少量酸或碱时,溶液的酸碱性变化不大。回答下列问题:
(1)将该溶液两等分,向其中加入少量盐酸时,发生反应的离子方程式为______;另一份加入少量KOH溶液时,发生反应的离子方程式为______。
(2)现将0.04molL-1HA溶液和0.02molL-1NaOH溶液等体积混合,得到缓冲溶液。
①若HA为HCN,该缓冲溶液显碱性,则溶液中c(Na+)______c(CN-)。(填“<”“=”或“>”);
②若HA为CH3COOH,该缓冲溶液显酸性。则溶液中所有的离子按浓度由大到小排列的顺序是______。
(3)缓冲溶液一般是由浓度较大的弱酸及其共轭碱所组成,其pH值的近似计算公式为:pH=pK酸+lg[c共轭碱/c酸]。人体血液中的H2CO3-HCO3-平衡起到缓冲作用。实测某人血液的pH=7.2,c(![]() )=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______mol/L。
)=2.3×10-2mol/L,且已知血液中的H2CO3的pKa1=6.2。则此人血液中的c(H2CO3)=______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
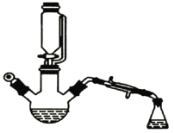
【题目】用下图所示装置制备乙酸乙酯粗产品(加热和夹持装置等省略),有关数据如下表所示:
物质 | C2H5OH | CH3COOH | CH3COOC2H5 |
密度g/cm3 | 0.79 | 1.05 | 0.90 |
沸点/℃ | 78.3 | 118 | 77.1 |
已知:乙醇可以和氯化钙反应生成微溶于水的CaC12·6C2H5OH。在三颈烧瓶内将过量的乙醇和少量的浓硫酸混合,然后经恒压分液斗边滴加酸,边加热蒸馏。得到含有乙醇、醋酸和水的乙酸乙酯粗产品。
(1)混合乙醇与浓硫酸时,应先加入的试剂是_______;浓硫酸的作用是__________。
(2)边滴加醋酸,边加热蒸馏的目的是_______。将粗产品再经下列步骤精制:
(3)为除去其中的醋酸,可向粗产品中加入______(填序号)。
A.无水乙醇 B.碳酸钠粉末 C.无水醋酸钠
(4)向其中加入饱和氯化钙溶液。振荡、分离。其目的是______。
(5)然后再向其中加入无水硫酸钠,振荡,静置,以除去水分。最后,将经过上述处理后的液体放入一干燥的蒸馏烧瓶内。再蒸馏,弃去低沸点馏分,收集沸程76℃~____℃(填“78”或“118“)之间的馏分即得纯净的乙酸乙酯。
(6)在实验中原料用量:23.0mL乙醇、15.0mL冰醋酸,最终得到16.0mL乙酸乙酯,则本次实验中乙酸乙酯的产率为________(百分数精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
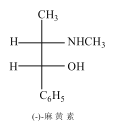
【题目】麻黄素D又称麻黄碱是一种天然的生物碱。天然麻黄素D的结构如图所示:
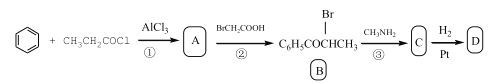
已知D的合成路线如下:
回答下列问题:
(1)写出反应①的化学方程式:______。指出其反应类型______。
(2)指出B中的官能团的名称______、D分子中有______个手性碳原子。
(3)出C→D的化学方程式:______。
(4)同时符合下列条件的C的同分异构体(不计立体异构)的数目共______种。
①属于对位二取代苯
②含有酰胺基(-CONH2)
(5)已知:R——NO2![]() R——NH2、氨基有碱性且易被氧化。设计一条由
R——NH2、氨基有碱性且易被氧化。设计一条由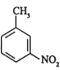 和乙醇为原料,制备
和乙醇为原料,制备 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务。该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中的x值。通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O,学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000 mol·L-1的酸性KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL。
(1)滴定时,将酸性KMnO4标准液装在如图中的________(填“甲”或“乙”)滴定管中。
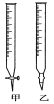
(2)本实验滴定达到终点的标志是___________________。
(3)通过上述数据,求得x=________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电解法可提纯含有某些含氧酸根杂质的粗KOH溶液,其工作原理如图所示。下列有关说法错误的是
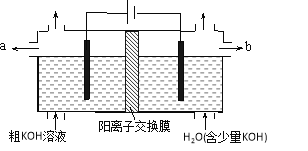
A. 通电后阴极区附近溶液pH会增大
B. 阳极反应式为4OH--4e-=2H2O+O2↑
C. 纯净的KOH溶液从b出口导出
D. K+通过交换膜从阴极区移向阳极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年“新冠”疫情在全球肆虐。下列说法不正确的是( )
A.酒精可以杀灭病毒是因为其能使构成病毒的蛋白质变性
B.研究表明,病毒可以通过气溶胶传播,气溶胶粒子的直径在![]() 之间
之间
C.口罩的核心材料熔喷布聚丙烯是一种有机高分子化合物
D.“84”消毒液的主要成分是HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com