
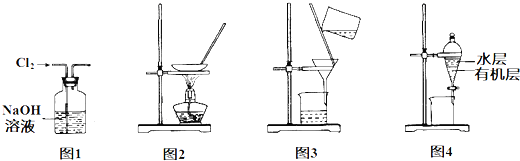
| A、图l 除去Cl2中含有的少量HCl | B、图2 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | C、图3 除去Fe(OH)3胶体中的FeCl3 | D、图4 分离CCl4萃取碘水后的有机层和水层 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
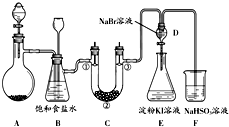 某课外小组同学用如图所示装置在实验室制备氯气并探究其相关性质(夹持设备已略).
某课外小组同学用如图所示装置在实验室制备氯气并探究其相关性质(夹持设备已略).| ① | ② | ③ | |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 硅 胶 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如下所示转化关系(部分产物及反应条件已略去)
已知A、B、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如下所示转化关系(部分产物及反应条件已略去)
查看答案和解析>>
科目:高中化学 来源:长乐二中2007年高考化学实验预测题 题型:058
| |||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:2012届福建省高三上学期期中考试化学试卷 题型:填空题
(14分)实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
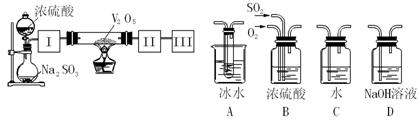
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为 。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ ,装置Ⅱ ,装置Ⅲ 。
(3)开始进行实验时,首先应进行的操作是 。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会 (填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是 (用含字母的代数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com