
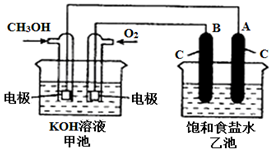
 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.分析 (1)甲池是燃料电池是原电电池装置,通入燃料CH3OH是负极;通入O2的电极是正极,所以电极反应式:O2+2H2O+4e-═4OH-;
(2)乙池中A是与燃料电池的负极相连,所以A是阴极;B极与电源的正极相连,所以C是阳极;
(3)乙池是电解饱和食盐水,反应的总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)活泼金属作为阳极,金属本身放电生成铜离子;
(5)乙池中A电极上析出氢气,根据转移电子数相等计算消耗氧气的量.
解答 解:(1)甲池是燃料电池是原电电池装置,通入燃料CH3OH是负极;通入O2的电极是正极,所以电极反应式:O2+2H2O+4e-═4OH-,故答案为:原电池;负极、O2+2H2O+4e-═4OH-;
(2)乙池中A是与燃料电池的负极相连,所以A是阴极;B极与电源的正极相连,所以C是阳极,电极反应式为:2Cl--2e-=Cl2,可用湿润的淀粉碘化钾试纸来检验氯气,故答案为:阴; 可用湿润的淀粉碘化钾试纸来检验氯气;
(3)乙池是电解饱和食盐水,反应的总反应的化学方程式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑;
(4)乙池中A电极上析出氢气,A(石墨)电极上共收集到气体0.1mol,则整个回路上转移电子的物质的量为0.2mol,所以甲池中理论上消耗O2的物质的量为:$\frac{0.2}{4}$=0.05mol,所以体积为:0.05mol×22.4L/mol=1.12L,所以为1120mL,故答案为:1120;
(5)B是阳极硝酸银离子中的氢氧根离子放电,生成氧气,电极反应式为:4OH--4e-═O2↑+2H2O,故答案为:4OH--4e-═O2↑+2H2O.
点评 本题考查了原电池和电解池原理,涉及电极反应式的书写、热化学反应方程式、物质的量的计算等知识点,这些知识点都是考试热点,根据串联电路中转移电子相等进行计算,难点是电极反应式的书写,题目难度中等.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 物质的量是一个基本物理量,表示物质所含粒子的多少 | |
| B. | 1mol氢中含有2mol氢原子和2mol电子 | |
| C. | 1molH2O的质量等于NA 个H2O 分子的质量总和 | |
| D. | 硫酸的摩尔质量是98g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | Br-Br | H-Br |
| 键能/(kJ•mol-1) | 436 | 193 | 366 |
| A. | +103 kJ•mol-1 | B. | +679 kJ•mol-1 | C. | -103 kJ•mol-1 | D. | +183 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
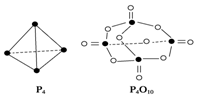 白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )
白磷与氧气可发生如下反应:P4+5O2═P4O10已知断裂下列化学键需要吸收的能量分别 为P-O:a kJ•mol-1、P-P:b kJ•mol-1、P═O:c kJ•mol-1 O═O:d kJ•mol-1.根据如图所示的分子结构和有关数据估算该反应的△H,其中正确的是( )| A. | (6b+5d-4c-12a) kJ•mol-1 | B. | (4b+5d-4c-12a) kJ•mol-1 | ||
| C. | (4c+12a-4b-5d) kJ•mol-1 | D. | (4c+12a-6b-5d) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 用如图所示装置进行实验,请回答下列问题:
用如图所示装置进行实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
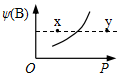 现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g);△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强P的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点比y点的正反应速率小 | D. | x点的混合物中v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑧ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com