
设NA为阿伏伽德罗常数的值,下列有关说法正确的是
A. 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA
B. 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA
C. 标准状况下,2.24L甲醇中含有C—H键的数目为0.3NA
D. 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源:江西省新余市、宜春中学2017届高三下学期开学联考理科综合-化学试卷 题型:选择题
设NA为阿伏加德罗常数的值,下列有关叙述正确的是 ( )
A. 在标准状况下,22.4 L C2H6中含共价键的数目为6 NA
B. 5 g KHCO3与CaCO3混合固体中阴离子数目为0.05 NA
C. 常温下,1 L 0.1 mol·L–1 CH3COONa溶液中CH3COO-离子数目为0.1 NA
D. 在Na2O2与H2O的反应中,当转移0.2 NA个电子时生成的O2体积为2.24 L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试化学试卷(解析版) 题型:选择题
化学用语是学习化学的重要工具,下列化学用语中,正确的是
A. NH4+的水解反应离子方程式:NH4++H2O NH3•H2O+H+
NH3•H2O+H+
B. 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-=AgI↓
C. 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu
D. 某反应△H<0,则该反应在任意条件下均可自发进行
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省牡丹江市高三2月开学检测理综化学试卷(解析版) 题型:简答题
(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g) 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44kJ·mol-1
④CH3CH2OH(l)+2O2(g) 2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
则 CO的燃烧热 ΔH =_________。
在图中画出,不同温度下(T1>T2),上述反应④中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。_________

(3)一定条件下,在体积为3 L的密闭容器中反应CO(g) + 2H2(g) CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
①反应的平衡常数表达式K=__________;根据下图,升高温度,K值将___________(填“增大”、“减小”或“不变”)。
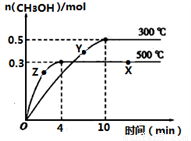
②500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是________。
③X点与Y点的平均速率:v(X)_________v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)________v逆(Z)(填“>”、“<”、“=”)。
④300℃时能够说明该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH) = v生成(H2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度相等
⑤500℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是___________。(填字母)
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的百分含量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:简答题
钛白粉(金红石晶型 TiO2)被广泛用于制造高级白色油漆。工业上以钛铁矿(主要成分为 FeTiO3,含有 Fe2O3 和 SiO2 等杂质)为原料制钛白粉的主要工艺如下:

回答下列问题:
(1)第②步所得滤渣的成分是________。
(2)操作④中需要控制条件以形成 TiO2·nH2O 溶胶,该工艺过程若要在实验室里完成,其中的“过滤”操作,可选用下列装置________(填选项)。

(3)第③步的实验操作是______、过滤,从而获得副产品 FeSO4·7H2O。
(4)为测定操作③所得滤液中TiO2+的浓度,取待测滤液10 mL 用蒸馏水稀释至100 mL,加入过量铝粉,充分振荡,使其完全反应:3TiO2+ + Al + 6H+ = 3Ti3+ + Al3+ + 3H2O。过滤后,取出滤液20.00 mL(加铝粉时引起溶液体积的变化忽略不计),向其中滴加2~3 滴KSCN溶液作指示剂,用 0.1000 mol·L-1NH4Fe(SO4)2 标准溶液滴定至溶液出现红色,此时溶液中 Ti3+全部被氧化为 Ti4+,消耗标准液30.00mL。回答下列问题:
①下列操作会使所测 TiO2+浓度偏高的是______。
A. 在配制标准液的过程中,未洗涤烧杯和玻璃棒
B. 在配制标准液定容是俯视刻度线
C.用蒸馏水洗涤后未经润洗的滴定管取待测液
D.在滴定终点读数时仰视滴定管刻度线
②求得待测滤液中 TiO2+的物质的量浓度是______。
(5)科学家从电解冶炼铝的工艺中得到启发,找出了冶炼钛的新工艺—TiO2 直接电解法生产钛,电解质为熔融的氯化钙,原理如图所示。
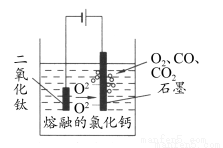
写出阴极电极反应式___________。
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:选择题
在15 mL0.10 mol·L-1NaOH 溶液中逐滴加入 0.20 mol·L-1 的氢氰酸(HCN,一元弱酸)溶液,溶液的pH和加入的氢氰酸溶液的体积关系曲线如下图所示,有关粒子浓度大小关系正确的是

A. 在 A、B 间任意一点:c(Na+)﹥c(CN-)﹥c(OH-)﹥c(H+)
B. 在 B 点:c(Na+) = c(CN-)﹥c( OH-) = c(H+),且 a=7.5
C. 在 C 点:c(CN-)﹥c(Na+)﹥c(OH-)﹥c(H+)
D. 在 D 点:c(HCN) + c(CN-)﹥2c(Na+)
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三下学期期初联考化学试卷(解析版) 题型:选择题
下列化学用语表述正确的是
A. NaCl的电子式为: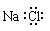 B. 水分子的比例模型:
B. 水分子的比例模型:
C. 乙烯的结构简式:CH2CH2 D. 硫离子结构示意图: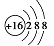
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省邯郸市高二下学期开学考试化学试卷(解析版) 题型:选择题
下列各组离子,在指定的环境中能够大量共存的是
选项 | 指定环境 | 能够共存的离子 |
A | 滴加酚酞显红色的溶液 | K+、S2-、SO32-、NO3- |
B | 有HCO3-存在的无色透明溶 | Na+、K+、Cl-、Al3+ |
C | 水电离的c(H+)=l0-12mol·L- 1的溶液中 | Cl-、CO32-、NO3-、NH4+ |
D | 使石蕊变红的溶液中 | Fe2+、MnO4-、NO3-、SO42- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com