
镁铝合金4.08 g溶于250 ml 2mol/L的盐酸中,标准状况下放出气体的体积为4.48 L,向反应后的溶液中加入500 ml NaOH溶液,充分反应后最终产生白色沉淀。下列有关说法不正确的是( )
A. 4.08 g镁铝合金中含有镁和铝的质量分别为1.92g、2.16g
B. 生成沉淀的最大质量为10.88 g
C. 若白色沉淀只有Mg(OH)2,该NaOH溶液的浓度至少为0.96mol/L
D. 溶解4.08 g镁铝合金时,剩余盐酸的物质的量为0.1 mol
科目:高中化学 来源:2017届海南省高三第七次月考化学试卷(解析版) 题型:选择题
某无色溶液中可能含有①Na+ 、②Ba2 +、③Cl一、④Br一、⑤SO32一、⑥SO42一 离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。

下列结论正确的是( )
A. 肯定含有的离子是①④⑤ B. 肯定没有的离子是②⑥
C. 不能确定的离子是① D. 不能确定的离子是③⑤
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
现将2molA和1molB加入2L密闭容器中发生反应:2A(g)+B(g)  2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是
2C(g),分别在Tl和T2时测得生成物C的物质的量随时间变化如图所示,下列说法正确的是
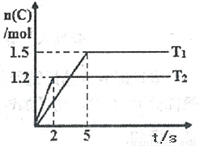
A. T1<T2
B. 该反应在温度为T1时达到平衡时,容器中A与C的物质的量浓度相等
C. 温度为T2时,2s内B的平均速率为0.3mol·L-1·s-l
D. 温度为T1时,达平衡时反应物A的转化率为60%
查看答案和解析>>
科目:高中化学 来源:2017届浙江省高三3月选考化学试卷(解析版) 题型:选择题
下列反应中,氧元素被还原的是
A. 2Na+O2 Na2O2 B. Na2O+H2O=2NaOH
Na2O2 B. Na2O+H2O=2NaOH
C. 2F2+ 2H2O=4HF+ O2 D. 2C+SiO2 2CO↑+Si
2CO↑+Si
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是( )
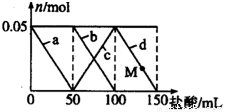
A. a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3
B. b和c曲线表示的离子反应是相同的
C. M点时Al(OH)3的质量小于3.9g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色的溶液,其化学方程式是:PbSO4+2NH4Ac Pb(Ac)2+(NH4)2SO4。当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是( )
Pb(Ac)2+(NH4)2SO4。当Pb(Ac)2(醋酸铅)溶液中通入H2S时,有黑色沉淀PbS和弱电解质HAc生成。表示这个反应的有关离子方程式正确的是( )
A. Pb(Ac)2+H2S PbS↓+2HAc
PbS↓+2HAc
B. Pb2++H2S PbS↓+2H+
PbS↓+2H+
C. Pb2++2Ac-+H2S PbS↓+2HAc
PbS↓+2HAc
D. Pb2++2Ac-+2H++S2— PbS↓+2HAc
PbS↓+2HAc
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高一下学期开学考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A. 1molCl2与Fe粉完全反应时转移电子数为2NA
B. 过氧化钠与水反应时,每生成1molO2,转移4mol电子
C. 标准状况下,11.2L氟化氢中含有氟原子的数目为0.5NA
D. 0.1 mol·L-1NaHSO4溶液中,阳离子数目之和为0.3NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年新疆哈密地区第二中学高二上学期期末考试化学试卷(解析版) 题型:选择题
下列除去杂质中,所有的除杂试剂不正确的是( )
序号 | 主要成分 | 杂质 | 所用除杂试剂 |
A |
|
|
|
B |
|
| 盐酸 |
C |
|
|
|
D | 工业用水 |
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三下学期第一次月考理科综合化学试卷(解析版) 题型:简答题
工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下:
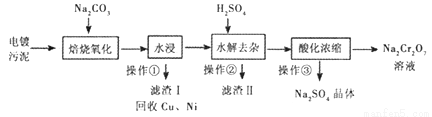
【查阅资料】
①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质;
②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表:

请回答:
(1)操作①的名称是_______,“水浸”后的溶液呈_______性;
(2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________;
(3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________;
(4)“酸化浓缩”时,需继续加入H2SO4,然后_______、结晶、过滤。继续加入H2SO4目的是__________;
(5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如图所示。

①阴极发生的电极反应式为:_____________;
②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com