
【题目】CO、H2 是重要的工业原料,在高温、催化剂存在的条件下,可用甲烷 和水蒸气为原料制取它:CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH0
CO(g)+3H2(g) ΔH0
(1)已知:
① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
则ΔH0 =_____。
(2)一定温度下,将一定量甲烷与水蒸气的混合气体置于某密闭容器中发生反应 生成 CO、H2,测得反应体系中平衡时的某种量值 X 与温度(T)、压强(P)之间的关系如图 所示:
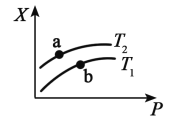
若 X 表示 CH4 的百分含量,则 T1_________T2(填“>”“<”“无法确定”,下同),X 还可 以表示_____(在下列选项中选填序号),a、b 两点的平衡常数 K(a) ____K(b)。
A.混合气体的平均摩尔质量 B.CO 的产率 C.ΔH 值
(3)若在 T3 时将 4mol H2O(g)与 a mol CH4 置于 2L 恒容密闭容器中,测得 CO 的 浓度(mol/L)与时间 t(min)的关系如图 所示。
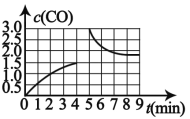
①反应 4min 后达平衡, 反应 4min 内用 H2浓度变化表示的反应速率 v(H2)=__________________
②若在第 5 分钟时改变条件,CO 浓度变化曲线如图 所示,则改变条件可能是____________
(4)从焓变角度上看,反应 CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)_____(填“具 有”或“不具有”)自发性。
【答案】+162 kJ/mol > A < 1.125mol/(L·min) 增加CO的量 不具有
【解析】
(1)根据盖斯定律计算CH4(g)+H2O(g)![]() CO(g)+3H2(g)的焓变;
CO(g)+3H2(g)的焓变;
(2)CH4(g)+H2O(g)![]() CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,CH4(g)的百分含量降低;正反应气体系数和增大,增大压强平衡逆向移动。
CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,CH4(g)的百分含量降低;正反应气体系数和增大,增大压强平衡逆向移动。
(3)①根据![]() 计算反应速率;
计算反应速率;
②由图象可知,反应 4min 后达平衡,若在第 5 分钟时改变条件,CO 浓度先突然增大后逐渐减小;
(4)吸热反应不易发生;
(1) ① 2H2(g)+O2(g)=2H2O(g) ΔH1=-484kJ·mol-1
② CH4(g)+1.5O2(g)=CO(g)+2H2O(g) ΔH2=-564kJ·mol-1。
根据盖斯定律②-①×![]() 得CH4(g)+H2O(g)
得CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH0 =-564kJ·mol-1-(-484kJ·mol-1)×
CO(g)+3H2(g) ΔH0 =-564kJ·mol-1-(-484kJ·mol-1)×![]() =+162 kJ/mol。
=+162 kJ/mol。
(2)CH4(g)+H2O(g)![]() CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,温度越高CH4(g)的百分含量越低,所以T1>T2;
CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,温度越高CH4(g)的百分含量越低,所以T1>T2;
A.增大压强,平衡逆向移动,混合气体的平均摩尔质量增大,所以X 还可以表示混合气体的平均摩尔质量;
B.增大压强,平衡逆向移动,CO 的产率降低,所以X不能表示CO 的产率;
C.ΔH只与热化学方程式的系数有关,增大压强ΔH值不变,所以X不能表示ΔH值;故选A;
平衡常数只与温度有关,CH4(g)+H2O(g)![]() CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,平衡常数增大,T1>T2,所以K(a) <K(b);
CO(g)+3H2(g),正反应吸热,升高温度平衡正向移动,平衡常数增大,T1>T2,所以K(a) <K(b);
(3)①反应 4min 内CO的浓度变化量为1.5mol/L,所以H2浓度变化量为4.5mol/L, ![]() 1.125mol/(L·min);
1.125mol/(L·min);
②由图象可知,反应 4min 后达平衡,若在第 5 分钟时改变条件,CO 浓度先突然增大后逐渐减小,则改变条件可能是增加CO的量;
(4)CO、H2的燃烧放热,所以CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)正反应吸热,吸热反应不易发生, 所以CO2(g)+H2O(g)=CO(g)+H2(g)+O2(g)不具有自发性。


科目:高中化学 来源: 题型:
【题目】用石墨电极电解200mLH2SO4和CuSO4的混合溶液,通电一段时间后,两极均收集到2.24L气体(标准状况),原混合溶液中Cu2+的物质的量浓度为( )
A.0.2mol·L-1B.0.3mol·L-1C.0.4mol·L-1D.0.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)
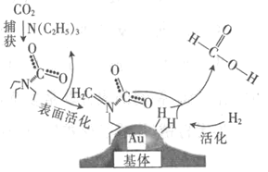
A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol·L-1的KOH溶液与0.1 mol·L-1的H2SO3溶液等体积混合后,溶液中各粒子浓度大小关系正确的是( )
A.c(K+)+c(H+)=c(OH-)+c(![]() )+c(
)+c(![]() )
)
B.2c(K+)=c(![]() )+c(
)+c(![]() )+c(H2SO3)
)+c(H2SO3)
C.c(K+)>c(![]() )>c(
)>c(![]() )>c(H2SO3)
)>c(H2SO3)
D.c(![]() )+c(
)+c(![]() )+c(H2SO3)=0.1 mol·L-1
)+c(H2SO3)=0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
实验目的 | 试剂 | 试管中的物质 | |
A | 羟基对苯环的活性有影响 | 饱和溴水 | ①苯 ②苯酚溶液 |
B | 甲基对苯环的活性有影响 | 酸性KMnO4溶液 | ①苯 ②甲苯 |
C | 苯分子中没有碳碳双键 | Br2的CCl4溶液 | ①苯 ②己烯 |
D | 碳酸的酸性比苯酚强 | 石蕊溶液 | ①苯酚溶液 ②碳酸溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是![]()
A.在含![]() 、
、![]() 、
、![]() 的溶液中逐滴加入硫酸氢钠溶液:
的溶液中逐滴加入硫酸氢钠溶液:![]() 、
、![]() 、
、![]()
B.含等物质的量的![]() 、
、![]() 的溶液中,缓慢通入氯气:
的溶液中,缓慢通入氯气:![]() 、
、![]() 、
、![]()
C.含等物质的量的![]() 、KOH的溶液中,缓慢通入
、KOH的溶液中,缓慢通入![]() :KOH、
:KOH、![]() 、
、![]() 、
、![]()
D.在含![]() 、
、![]() 、
、![]() 的溶液中逐渐加入烧碱溶液:
的溶液中逐渐加入烧碱溶液:![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,BaSO4(s)![]() Ba2+(aq) + SO42-(aq)体系中, c(Ba2+)和c(SO42-)关系如图所示。下列说法正确的是
Ba2+(aq) + SO42-(aq)体系中, c(Ba2+)和c(SO42-)关系如图所示。下列说法正确的是
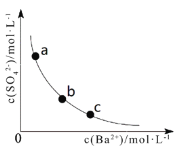
A.a、b、c三点对应的Ksp相等
B.BaSO4在c点的溶解度比b点的大
C.BaSO4溶于水形成的饱和溶液中,c(Ba2+)=c(SO42-)
D.b点的溶液中加入BaCl2固体,c(SO42-)沿曲线向a点方向变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com