
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)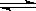 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是 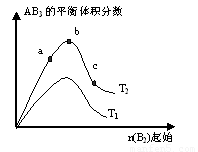
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之比接近3∶1
C
【解析】
试题分析:A、由于不知道T2与T1的大小关系,所以不能判断反应时吸热还是放热,故错B、曲线先增加,原因是加入气体B2时,平衡正向移动。然后曲线再降低,原因是通入的气体量大,总气体体积增大显著。使得AB3的体积分数减小,实际上平衡仍旧在向正向移动,所以转化率比较应该是c>b>a。故错。
C、若T2>T1,温度越高,平衡时含量AB3越多,平衡正移,则正反应是吸热反应,故正确。
D、b点时,平衡体系中A、B原子数之比接近1∶3故错
考点:化学平衡状态的判断,温度对化学反应的影响。
点评:本题难度适中,利用勒夏特列原理来解题,注意温度对化学平衡的影响。本题需要把图像看懂,首先看横纵坐标,再看曲线的变化,再分析变化的原因。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 (2009?浙江模拟)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是( )
(2009?浙江模拟)某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学科研小组研究在其它条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响时,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论中正确的是( )
某化学科研小组研究在其它条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响时,得到如图所示的变化规律(图中T表示温度,n表示物质的量),根据图示得出的结论中正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
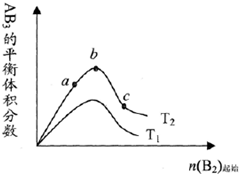 某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度)由此可得出的结论是( )
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)?2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度)由此可得出的结论是( )| A、反应速率a>b>c | B、达到平衡时A2的转化率大小为:b>a>c | C、若T2>T1,则正反应一定是吸热反应 | D、达到平衡时,AB3的物质的量大小为:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、反应Ⅰ:△H>0,P2>P1 | B、反应Ⅱ:△H<0,T1<T2 | C、反应Ⅲ:△H>0,T2>T1或△H<0,T2<T1 | D、反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com