
【题目】有![]() (a).
(a). ![]() (b).
(b). ![]() (c)的分式均为C5H6,下列有关叙述正确的是
(c)的分式均为C5H6,下列有关叙述正确的是
A. 符合分子式为C5H6的同分异构体只有a、b、c三种
B. a、b、c的一氯代物都只有三种
C. a、b、c都能使溴的CCl4溶液褪色,且褪色原理相同
D. a、b、c分子中的5个碳原子一定都处于同一个平面
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】高分子化合物PA66的合成路线如下:

已知: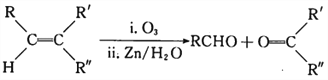
(1)A属于芳香化合物,其结构简式是____________。
(2)①的化学方程式是____________。
(3)C中所含官能团的名称是____________。
(4)②的反应条件是____________。
(5)④的化学方程式是____________。
(6)![]() 有多种同分异构体,符合下列条件的有______种,写出其中任意一种同分异构体的结构简式:_____
有多种同分异构体,符合下列条件的有______种,写出其中任意一种同分异构体的结构简式:_____
i.为链状化合物且无支链;ii.为反式结构;III.能发生银镜反应。
(7)已知:RCH=CH2![]() RCH2CH2COOCH3
RCH2CH2COOCH3
有机物C可由2-丁烯经4步反应合成,请结合题中信息补充完整下列合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。____
CH=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.2mol/LH2C2O4溶液中滴加0.2mol/LKOH溶液,水电离出氢离子浓度c(H+)与加入氢氧化钾溶液的体积的变化如下图,已知常温下,H2C2O4的电离常数为:K1=5.0×10-2,K2=5.4×10-5,根据图示判断,下列说法不正确的是( )
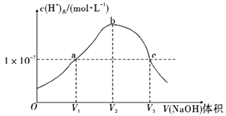
A. c点的溶液显碱性
B. a点时,加入KOH溶液的体积V1=10mL
C. b点时,溶液中各粒子浓度的大小顺序为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+)
D. 当V(KOH)=15mL时,溶液中存在以下关系:2c(K+)=3c(C2O42-)+3c(HC2O4-)+3c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是丁烷(C4H10)裂解的实验流程。连接好装置后,需进行的实验操作有:①检置整套装置的气密性②排出装置中的空气③给D、G装置加热等……;G后面装置以及铁架台等已省略;CuO能将烃氧化成CO2和H2O。
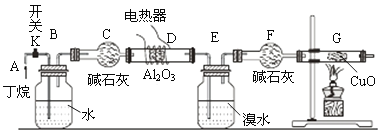
请回答下列问题:
(1)丁烷裂解的可能方程式为C4H10![]() CH4+C3H6,____________________;
CH4+C3H6,____________________;
(2)写出甲烷与氧化铜反应的化学方程式_____________________________;
(3)若对反应后E装置中的混合物(溴水足量),再按以下流程实验:
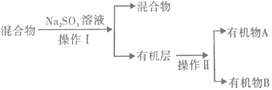
①分离操作Ⅰ和Ⅱ的名称分别是___________、___________(填字母) ;
a.蒸发 b.过滤 c.分液 d.蒸馏
②Na2SO3溶液的作用是(用离子方程式表示)_____________________________________________;
③已知A的碳原子数大于B的碳原子数,请写出B的名称______________________;
(4)假定丁烷完全裂解,流经D、G装置中的气体能完全反应。当(E+F)装置的总质量比反应前增加了0.49g,G装置的质量比反应间减少了1.44,则丁烷的裂解产物中甲烷和乙烷的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当前煤炭在我国的能源消费中占60%以上,它在给我们提供廉价能源的同时,燃烧生成的SO2、NOx等也造成了比较严重的大气污染问题。
(1)向燃煤中加入CaO,煤中硫元素大多数会转化为CaSO4,故CaO能起到固硫、降低SO2排放量的作用。
已知:①SO2(g)+CaO(s)=CaSO3(s) △H=-402kJ·mol-1
②2CaSO3(s)+O2(g)=2CaSO4(s) △H =-234.2 kJ·mol-1
③CaCO3(s)=CO2(g)+CaO(s) △H=+178.2 kJ·mol-1
则反应2SO2(g)+O2(g)+2CaO(s)=2CuSO4(s) △H =________kJ·mol-1。
向燃煤中加入CaCO3也可起到固硫作用,若固定2molSO2,相应量的煤在相同条件下燃烧时向环境释放出的热量会减少______________kJ。
(2)活性炭对NO2有较强的吸附性,二者之间可发生2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
N2(g)+2CO2(g) △H,为研究温度、压强等外部因素对该反应的影响,某科研小组向密闭容器中加入2molNO2和足量的活性炭,进行如下实验探究:
i.固定密闭容器的体积为5L,测得恒容时不同温度下NO2的转化率(ɑ)与时间(t)的关系如图1所示:

①该反应的△H_________0填“>”或“<”),温度为T2时,反应开始到达到平衡的时间段内v(N2)=_____________。
②温度为T1时该反应的平衡常数K=________,若保持温度不变,提高NO2转化率的方法是___________。
ⅱ.保持容器中的温度恒定,测得20s时,CO2的体积分数(φ)与压强(p)的关系如图Ⅱ所示。
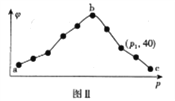
③图Ⅱ曲线呈现先增后减的变化趋势,其原因为______________________,压强为p1时,第20s时容器中c(NO2):c(N2)=_______________。
(3)常温下,用NaOH溶液吸收SO2既可消除大气的污染,又可获得重要的化工产品,若某吸收液中c(HSO3-):c(SO32-)=1:100,则所得溶被的pH=____________(常温下K1(H2SO3)=1.5×10-2、K2(H2SO3)=1×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普通电解精炼铜的方法所制备的铜中仍含杂质,利用下面的双膜( 阴离子交换膜和过滤膜)电解装置可制备高纯度的Cu。下列有关叙述正确的是
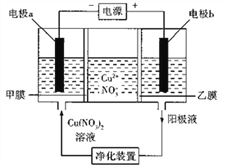
A. 电极a为粗铜,电极b为精铜
B. 甲膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区
C. 乙膜为阴离子交换膜,可阻止杂质阳离子进入阴极区
D. 当电路中通过1mol电子时,可生成32g精铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示在一定的温度下,容积固定的密闭容器中,A、B、C三种气体物质的浓度随时间变化的情况,试回答下列问题:
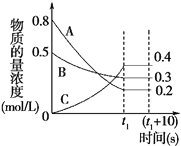
(1)该反应的化学方程式为_________________。
(2)0~t1s内B气体的平均反应速率为____________。
(3)(t1+10)s时,A的转化率为_____。
(4)关于该反应的说法正确的是_________。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com