
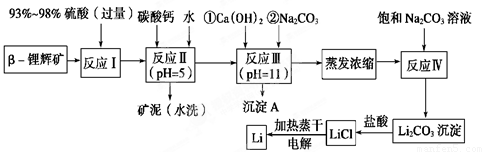
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:______________________________________。
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称___________,洗涤所得Li2CO3沉淀要使用______________ (选填“热水”或“冷水”),你选择的理由是________________。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:__________________________。
(1)Li2O?Al2O3?4SiO2 ?
(2)除去反应Ⅰ中过量的H2SO4;控制pH,使Fe 3+、A l 3+完全沉淀
(3)Mg2++2OH-=Mg(OH)2↓、Ca 2++CO32-=CaCO3↓
(4)过滤 热水 Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗
(5)加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2
【解析】
试题分析:(1)硅酸盐既可以用盐的形式表示母液可以用氧化物的形式表示。在用氧化物形式表示时要符合质量守恒定律。且一般情况下,金属氧化物写在前面,非金属氧化物写在后面。LiAlSi2O6的氧化物的形式表示为Li2O?Al2O3?4SiO2? 。(2)反应Ⅱ加入碳酸钙是为了除去反应Ⅰ中过量的H2SO4;控制pH,使Fe 3+、A l 3+完全沉淀。(3)根据框图中物质之间的转化关系可知反应Ⅲ中生成沉淀A的离子方程式为Mg2++2OH-=Mg(OH)2↓、Ca 2++CO32-=CaCO3↓。(4)反应Ⅳ中由于Li2CO3溶解度小,所以生成Li2CO3沉淀,在实验室中从溶液中分离得到Li2CO3沉淀的操作是过滤。因为Li2CO3的溶解度随温度的升高而降低,所以洗涤所得Li2CO3沉淀要使用热水。(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气是因为在加热蒸干LiCl溶液时,LiCl有少量发生水解反应生成LiOH,它受热分解生成Li2O,电解时产生O2。因此制取的氯气中常含有少量的O2。
考点:考查硅酸盐的氧化物形式的表示、离子方程式的书写、混合物的分离方法、及电解原理的知识。


科目:高中化学 来源:2013届广东省惠阳一中实验学校高三9月月考理科综合化学试卷(带解析) 题型:填空题
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下: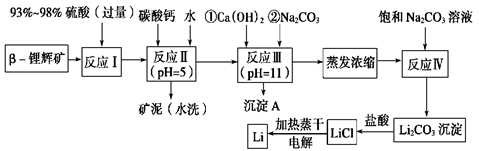
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省实验学校高三9月月考理科综合化学试卷(解析版) 题型:填空题
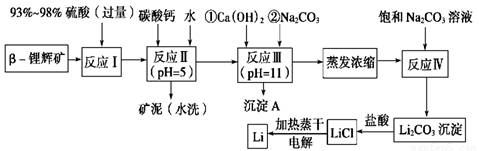
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
2.7 |
3.7 |
9.6 |
|
完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
|
温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
|
Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:______________________________________。
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称___________,洗涤所得Li2CO3沉淀要使用______________ (选填“热水”或“冷水”),你选择的理由是 。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com