
����Ŀ��1840�꣬������ѧ�Ҹ�˹��Hess��ָ������һ����ѧ��Ӧ��������һ����ɣ����Ƿּ�����ɣ����ܵ���ЧӦ����ȫ��ͬ�ġ�������������ġ���˹���ɡ�������֪��101KPa��CH4��H2��C���̣���ȼ���ȷֱ�Ϊ890.83kJ��mol-1��285.83kJ��mol-1��393.51 kJ��mol-1����ӦC(s)+2H2(g)=CH4(g)�ķ�Ӧ�ȡ�H��___��
���𰸡�-74.34kJ��mol-1
��������
ʵ����̼���ʡ������������ȼ����(��H)�ֱ�Ϊ890.83kJ��mol-1��285.83kJ��mol-1��393.51 kJ��mol-1����
���ǵ��Ȼ�ѧ��Ӧ����ʽ�ֱ�Ϊ��
��C(s)+O2(g)=CO2(g)��H=-393.5kJ/mol
��H2(g)+ ![]() O2(g)=H2O(l)��H=-285.83kJ/mol
O2(g)=H2O(l)��H=-285.83kJ/mol
��CH4(g)+2O2(g)=CO2(g)+2H2O(l)��H=-890.83kJ/mol
���ݸ�˹���ɣ��ɢ�+����2-�۵�C(s)+2H2(g)=CH4(g)����H= [(-393.5kJ/mol)+(-285 83kJ /mol)��2]- (-890. 83kJ/mol)= -74.34kJ/mol���ʴ�Ϊ��-74.34kJ/mol



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1mol/L�����NaOH��Һ�ζ������Ϊ20 mL��Ũ�Ⱦ�Ϊ0.1mol/L��MOH��HX��Һ���ζ�������ͼ��ʾ������˵���������

A.�����ζ�ʵ������÷�̪��ָʾ��
B.������0.1mol/LMX��Һ��pH<7
C.a����Һ�д��ڣ�c(X-)>c(HX)
D.b����Һ�д��ڣ�2c(MOH)+c(M+)+c(OH-)=c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaN3����һ����ɫ���壬�����������Ʊ�����Ϊ2NaNH2��N2O==NaN3��NaOH��NH3��3NaNH2��NaNO3==NaN3��3NaOH��NH3����
�ش��������⣺
��1����Ԫ�����ڵ������У��縺������Ԫ����________����һ��������С��Ԫ����_______��
��2����̬��ԭ�ӵ�L������Ų�ͼΪ_________________��
��3����N3-��Ϊ�ȵ�����ķ���Ϊ_________��д��һ�֣������ݼ۲���ӶԻ������ۣ�NO3-�Ŀռ乹����______________��������ԭ���ӻ�������__________��
��4�������������������Ļ�ѧ��������_____________��
A�����Ӽ� B�����Թ��ۼ� C������ D������
��5��N2O�е㣨-88.49������NH3�е㣨-33.34�����ͣ�����Ҫԭ����____________________________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��
��C��s����1/2O2��g����CO��g�� ��H1����110.5kJ/mol
��ϡ��Һ�У�H+��aq����OH-��aq����H2O��l�� ��H2����57.3kJ/mol
���н�����ȷ���ǣ� ��
A.��̼��ȼ��������H3����ʾ������H3<��H1
B.H2SO4��Ca��OH��2��Ӧ���к�����H��2������57.3��kJ��mol-1
C.��Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ
D.ϡ������ϡNaOH��Һ��Ӧ���� 1molˮ���ų�������С��57.3kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�ݻ�Ϊ2 L���ܱ������ڼ���0.2 mol ��N2��0.6 mol ��H2����һ�������·������·�Ӧ��N2(g)��3H2(g)![]() 2NH3(g) ��H��0,��Ӧ��NH3�����ʵ���Ũ�ȵı仯���������ͼ��
2NH3(g) ��H��0,��Ӧ��NH3�����ʵ���Ũ�ȵı仯���������ͼ��
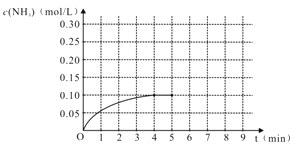
��1��������ͼ������ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ����Ӧ����v(NH3)Ϊ_________________��
��2���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽK=___________________��
��3����Ӧ�ﵽƽ���5����ĩ�����������������䣬���ı䷴Ӧ�¶ȣ���NH3�����ʵ���Ũ�Ȳ�����Ϊ________��
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
��4����Ӧ�ﵽƽ���5����ĩ�����������������䣬��ֻ�������������Сһ�룬ƽ��_________________________�ƶ����������淴Ӧ����������������Ӧ��������������������ѧƽ�ⳣ��________________������������������С����������������
��5���ڵ�5����ĩ�������������Сһ������ڵ�8����ĩ�ﵽ�µ�ƽ�⣨��ʱNH3��Ũ��ԼΪ0.25 mol/L����������ͼ�л�����5����ĩ����ƽ��ʱNH3Ũ�ȵı仯���ߡ�___________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ԡ���ԭ�Ե�ǿ�������������ʵĽṹ�йأ��������ʵ�Ũ�Ⱥͷ�Ӧ�¶��йء����и������ʣ���Cu��HNO3��Һ ��Cu��FeCl3��Һ ��Zn��H2SO4��Һ ��Fe��HCl��Һ ����Ũ�Ȳ�ͬ���ܷ�����ͬ������ԭ��Ӧ����
A. �ۢ�B. �٢�C. �٢�D. �٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z���ֶ�����Ԫ�أ����������ڱ���λ����ͼ��ʾ������˵������ȷ���ǣ� ��
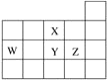
A.W��Y��X����Ԫ�ص�ԭ�Ӱ뾶���μ�С
B.ZԪ�صļ���̬�⻯������ȶ��Ա�Y�ĸ�
C.Z�ķǽ����Ա�Y��ǿ������Z�⻯��ķе��Y�ĸ�
D.YԪ�صĵ����ܴ�NaZ��Һ���û���ZԪ�صĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͼ��

���з�Ӧ�з�������ͼ�����(����)
A. N2(g)��3H2(g)![]() 2NH3(g) ��H��0
2NH3(g) ��H��0
B. 2SO3(g)![]() 2SO2(g)��O2(g) ��H��0
2SO2(g)��O2(g) ��H��0
C. 4NH3(g)��5O2(g)![]() 4NO(g)��6H2O(g) ��H��0
4NO(g)��6H2O(g) ��H��0
D. H2(g)��CO(g)![]() C(s)��H2O(g) ��H��0
C(s)��H2O(g) ��H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�������ϣ���ѧ�����ȶ��������Ըߣ��������õ����ԡ������ԺͶ������ߵ������ԣ���ij�ֹ�ҵ���Է�Һ(��Ҫ��Na����Fe2����Fe3����Mg2����Al3����Cl����SO42-)�л����������������£�

��֪��������Ksp[Mg(OH)2]��1.2��10��11��Ksp[Fe(OH)2]��2.2��10��16��Ksp[Fe(OH)3]��3.5��10��38��Ksp[Al(OH)3]��1.0��10��33
(1)д���ڸ����Է�Һ��ͨ�����ʱ���������ӷ�Ӧ����ʽ��___________��ָ��ʹ�ÿ������ŵ��ǣ�_________��
(2)��֪Fe3��(aq)��3OH��(aq)===Fe(OH)3(s)��H����Q1kJ��mol��1����(1)��ÿ����1 mol������ʱ������Q2���������1 mol Fe2��ȫ��ת��ΪFe(OH)3(s)����ЧӦ��H��_________��
(3)�����£�������֪����������pH��5����Һ�У��������������ڸ���Һ�пɴ��ڵ����Ũ��c(Fe3��)��___________��c(Mg2��)��___________��
(4)�����ð�ˮ������ҺpH����pH��5ʱ��Fe(OH)3������������ʱFe(OH)3�����п��ܻ��е�������______ (�ѧʽ����ͬ)����_______�Լ��ɽ����ȥ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com