

分析 (1)分子结构为正四面体的为四氯化碳;常用分馏的方法分离;
(2)CF3CHClBr对应的同分异构体中,可根据卤素原子的位置不同判断;
(3)①依据当试管堵塞时,气体不畅通,则在甲气体产生的压强将水压入直玻璃管中,甚至溢出玻璃管;水可以除去乙烯气体中的乙醇蒸汽;
②试管中乙烯和溴发生加成反应;由于溴被消耗,据此分析现象;冷水能使生成的1,2一二溴乙烷冷凝,减少挥发引起的损失;
③反应剩余的溴化氢、溴等有毒,能够污染大气,需要进行尾气吸收,用氢氧化钠吸收.
解答 解:(1)分子结构为正四面体的为四氯化碳,工业上分离这些多氯代甲烷,根据物质的沸点不同,常用分馏的方法分离,故答案为:四氯化碳;分馏;
(2)CF3CHClBr对应的同分异构体中,可根据卤素原子的位置不同判断,如F不在同一个C原子上,存在的同分异构体有CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2三种,
故答案为:CHFClCF2Br、CHFBrCF2Cl、CFClBrCHF2;
(3)①试管内发生堵塞时,甲中压强不断增大,会导致甲中水面下降,玻璃管中的水柱上升,甚至溢出;水可以除去乙烯气体中的乙醇蒸汽.
故答案为:安全瓶;甲中水面会下降,玻璃管中的水柱会上升,甚至溢出;除去乙烯中的乙醇蒸汽;
②试管中乙烯和溴发生加成反应:CH2=CH2+Br2→CH2BrCH2Br;由于溴被消耗,故反应完的现象是溴水的橙黄色退去,生成了油状液体;冷水能使生成的1,2一二溴乙烷冷凝,减少挥发引起的损失;故答案为:CH2=CH2+Br2→CH2BrCH2Br;溴水的橙黄色退去,生成了油状液体;使生成的1,2一二溴乙烷冷凝,减少损失.
③该反应中剩余的溴化氢及反应副产物溴单质等有毒,会污染大气,应该进行尾气吸收,所以氢氧化钠溶液的作用是吸收HBr和Br2等气体,防止大气污染,化学方程式为:HBr+NaOH=NaBr+H2O,Br2+2NaOH=NaBr+NaBrO+H2O.
故答案为:防止大气污染;HBr+NaOH=NaBr+H2O,Br2+2NaOH=NaBr+NaBrO+H2O.
点评 本题考查了制备实验方案的设计、溴乙烷的制取方法,题目难度中等,注意掌握溴乙烷的制取原理、反应装置选择及除杂、提纯方法,培养学生分析问题、解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理量 实验序号 | V(溶液)/mL | NH4Cl/g | 温度/℃ | pH | … |
| 1 | 100 | m | T1 | … | |
| 2 | 100 | m | T2 | … | |
| 3 | 100 | 2m | T2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2在高压、低温下变成雪状固体 | |
| B. | CO2通入澄清的石灰水,石灰水变浑浊 | |
| C. | CO2通入紫色石蕊试液,试液变红色 | |
| D. | CO2通过赤热的炭变成CO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
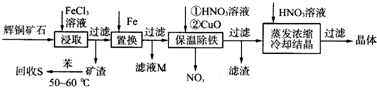
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com