
 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).分析 (1)分离互不相溶的液体,采取分液方法进行分离;
(2)若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性;
(3)①蒸馏操作时会有部分加合物随温度的升高而挥发,如果不使用冷凝管使之液化后重新流入烧瓶内,会使得到的乙醛不纯,另外原料利用率也低;应使整个冷凝管充满冷凝水,充分冷却回流;
②气泡从下到上升至液面过程中,体积越来越小,直至完全消失,说明气体溶于溶液,当观察到导气管中气流很小时,要将导管从溶液中 取出,以防止倒吸.
解答 解:(1)久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液,先分离混合物得到(C2H4O)n,基本方法是:将混合物放入分液漏斗中,静置分层后,打开活塞,将下层液体放入烧杯中,然后把上层的油状液体(C2H4O)n从分液漏斗的上口倒出,
故答案为:分液漏斗;分液;
(2)若乙醛被氧化,则生成CH3COOH,下层液呈酸性,可以利用石蕊试液检验下层液是否呈酸性,具体操作为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化,
故答案为:取少量下层水溶液,滴加石蕊试液,如果溶液呈红色,说明部分乙醛已被氧化;
(3)①利用冷凝管使挥发出的加合物液化后重新流入到烧瓶内,这样既保证了乙醛的纯度,也提高了原料的利用率,
应使整个冷凝管充满冷凝水,充分冷却回流,即冷凝水从b口通入,从a口流出,
故答案为:使加合物冷凝回流到烧瓶内;b;
②气泡从下到上升至液面过程中,体积越来越小,直至完全消失,说明乙醛易溶于水,当观察到导气管中气流很小时,要将导管从溶液中 取出,以防止倒吸,
故答案为:易溶于水;及时撤去导管;防止倒吸.
点评 本题考查混合物的分离和提纯、实验方案设计、乙醛的性质等,注意化学实验中安全意识的渗透、制备实验中原料尽可能充分利用,难度中等.


科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
| 55 | SO2 | II | 良 |
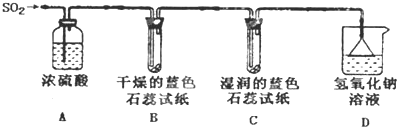
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
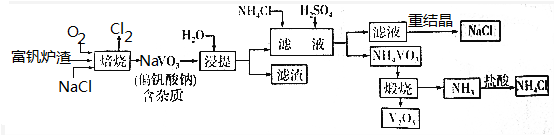
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.
A、B、C、D、E、F为前四周期元素,它们的原子序数依次增大.A、C的基态原子的电子排布中L能层都有两个未成对电子,C、D同主族,E的基态原子的电子排布中有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满. .
. .DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.
.DAB-的水溶液可以用于实验室中E3+离子的定性检验,形成配合物的颜色为血红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M的气态氢化物与其最高价氧化物的水化物之间能相互反应 | |
| B. | N单质能将K从其钠盐的水溶液中置换出来 | |
| C. | N的氢化物沸点高于其它同族元素氢化物的沸点 | |
| D. | P、Q、K对应的最高价氧化物的水化物相互之间可能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L庚烷的分子数约为NA | |
| B. | 1L 0.1mol•L-l的Na2S溶液中S2-和HS-的总数为0.1NA | |
| C. | 4.0 gH218O与D2O的混合物中所含中子数为2NA | |
| D. | 50mL 12 mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 探究Na与水的反应可能有O2生成 | |
| B. | 探究SO2和Na2O2反应可能有Na2SO4生成 | |
| C. | 探究足量的铜与一定量的浓硝酸反应的气体产物是NO还是NO2 | |
| D. | 探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的现象是溶液的酸碱性改变所致,还是HClO的漂白性所致 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
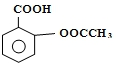 阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )
阿司匹林(Aspirin)也叫乙酰水杨酸(结构如图所示)是一种常用的解热镇痛、抗风湿类药物,广泛应用于临床治疗和预防心脑血管疾病,近年来还不断发现它的新用途.下列有关说法正确的是( )| A. | 与乙酰水杨酸具有相同官能团的芳香族同分异构体共有8种(不考虑立体异构) | |
| B. | 乙酰水杨酸能发生取代、加成、氧化、还原反应 | |
| C. | 乙酰水杨酸的所有原子均在同一平面上 | |
| D. | 服用阿司匹林药量过大时,可出现精神错乱、惊厥甚至昏迷等水杨酸反应,可用硼酸溶液解毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com