
甲、乙两烧杯中各盛有100 mL 3 mol·L-1的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的气体体积比为V(甲)∶V(乙)=1∶2,则加入铝粉质量为( )
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是

A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(Na+)>c(B-)> c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。反应中镁和铝的( )

A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加在足量的下列溶液中,充分反应后,放出氢气最多的是( )
A.3 mol/L HCl B.4 mol/L HNO3 C.8 mol/L NaOH D.18 mol/L H2SO4
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:选择题
在100 ℃时,3.88 g 的气体A与足量的Na2O2反应,可放出氧气,且固体的质量增加了2.28 g,由此可知,A的组成为( )
A.只有水蒸气 B.只有二氧化碳 C.水蒸气和二氧化碳 D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:实验题
过碳酸钠(2Na2CO3·3H2O2)广泛用于洗涤、纺织、医疗、造纸等。某兴趣小组展开了深入的学习:
【资料卡片】:

I、制备研究:工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(化学式为2Na2CO3·3H2O2), “醇析法”的生产工艺流程如下:

请回答问题:
(1)Na2CO3俗名:_______________;其水溶液能使酚酞变_______________;
(2)H2O2受热容易分解,写出该分解反应的方程式:_________________;
(3)生产过程中,反应及干燥均需在低温度下进行,原因是________________;
(4)生产过程中,加入较多无水乙醇后,过碳酸钠晶体大量析出,此无水乙醇的作用可能是_________________;
(5)操作A的名称是______________,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和_____________;
(6)母液可以循环使用,但须进行“一系列操作”分离,这些操作包括:加入少量___________,不再有气泡产生后,过滤,将所得滤液再进行______________(填操作名称),即可得Na2CO3溶液和95%的乙醇。为获取无水乙醇,还需进行的操作是:向95%的乙醇中加入足量CaO后,选__________(填序号)装置进行实验。

II、纯度测定:兴趣小组同学设计了如图1所示实验装置(部分仪器略去),测定过碳酸钠样品中2Na2CO3·3H2O2的质量分数。步骤如下:

① 连接仪器并检查好气密性
② 将过碳酸钠样品(2.20g)和少许MnO2均匀混合后置于装置A中,在量筒中加满水;
③ 连接仪器,打开滴液漏斗活塞,缓缓滴入水;
④ 待装置A中_____________时,停止滴加水,并关闭活塞;
⑤ 冷却至室温后,平视读数;
⑥ 根据数据进行计算。
请回答下列问题:
(7)完善实验步骤的相关内容:④ __________;
(8)第⑤中,已“冷却至室温”的判断依据是:_____________;
(9)量筒中,加装的长导管的作用是:______________;
(10)实验中,______________,则开始收集气体;
A.刚开始出现气泡时
B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(11)量筒的局部示意见图2,平视读数时应沿____________视线(选填“a”或“b”) 进行。图中________视线(选填“a”或“b”)对应的读数较大。

(12)若量筒中收集到气体的体积是224mL (己转化为标准状况下的数据),计算过碳酸钠样品中2Na2CO3·3H2O2的质量分数:_____________;[Mr(O2)=32、Mr(2Na2CO3·3H2O2)=314]
(13)经过讨论,小组同学一致认为测定结果偏大,理由是_________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
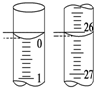 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\stackrel{H+}{→}$n(C2H4O).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com