
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是__。
A.KMnO4 B.H2O2 C.Cl2水 D.HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的__。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,已知Ksp(AmBn)=[c(An+)]m.[c(Bm-)]n,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为__,Fe3+完全沉淀时溶液的pH为__,通过计算确定上述方案__(填“可行”或“不可行”)。(提示:lg2=0.3)
【答案】B CD 4 3.3 可行
【解析】
(1)除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,四个选项中,只有双氧水氧化后生成水,双氧水受热见光易分解,没有多余杂质,故选B;
调整溶液的pH时,加入的物质不能引进新的杂质粒子,氢氧化钠中含有钠离子,氨水反应后生成铵根离子,所以氢氧化钠和氨水能引进新的杂质离子,CuO粉末、Cu(OH)2悬浊液反应后生成铜离子和水而不引进新的杂质离子,故选CD。
故答案为:B;CD;
(2)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0mol·L-1,c(Cu2+)=3.0mol·L-1;依据溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20 ;c2(OH-)=3×10-20÷3.0=10-20;得到c(OH-)=10-10mol·L-1,依据水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=10-4mol·L-1,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;
残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=![]() =8.0×10-33;c(OH-)=2×10-11mol·L-1;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol·L-1,则pH=3.3;
=8.0×10-33;c(OH-)=2×10-11mol·L-1;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol·L-1,则pH=3.3;
通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行。
故答案为:4;3.3;可行。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.1 mol Cl2参加反应转移电子数一定为2NA
B.在反应KIO3 + 6HI = KI + 3I2 +3H2O中,每生成3 mol I2转移的电子数为6NA
C.根据反应中HNO3(稀)![]() NO,而HNO3(浓)
NO,而HNO3(浓)![]() NO2可知,氧化性:HNO3(稀) > HNO3(浓)
NO2可知,氧化性:HNO3(稀) > HNO3(浓)
D.含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如图所示。

已知:①核磁共振氢谱显示A有两个峰,其强度之比为1∶1。
②CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
③CH3CHO+CH3CHO![]()

![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
请回答下列问题:
(1)A的结构简式为________ ,G中官能团的名称为________。
(2)检验M已完全转化为N的实验操作是______
(3)有学生建议,将M→N的转化用KMnO4 (H+)代替O2,你认为是否合理______(填“是”或“否”)原因是_________(若认为合理则不填此空)。
(4)写出下列转化的化学方程式,并标出反应类型:K→L________,反应类型________。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有_____种。(不考虑立体异构)
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上只有2个对位取代基
(6)以丙烯和NBS试剂为原料制备甘油(丙三醇),请设计合成路线______(其他无机原料任选)。请用以下方式表示:A![]() B
B![]() 目标产物
目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、D、E的原子序数依次增大,B、E位于同主族,四种元素的一种化合物的结构式如图所示。下列说法不正确的是
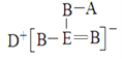
A.B的最简单氢化物的沸点比E的高
B.D和E形成的三核二元化合物的水溶液中,阴、阳离子的浓度之比小于1:2
C.化合物DA的水溶液呈碱性
D.同时含有A、B、D、E四种元素的盐至少有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是

A. 加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B. 向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
C. 隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
D. 烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,
是四种短周期元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 、
、![]() 同主族。
同主族。![]() 的原子结构示意图为
的原子结构示意图为 ,
,![]() 、
、![]() 形成的化合物的电子式为
形成的化合物的电子式为![]() ,下列说法正确的是( )
,下列说法正确的是( )
A.原子半径:![]()
B.电负性:![]()
C.原子序数:![]()
D.最高价氧化物对应水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在国防建设、工农业生产和生活中有广泛的用途。请回答下列问题:
(1)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。
① 若氨水的浓度为2.0 mol·L-1,溶液中的c(OH)=_________________mol·L1。
②将SO2通入2.0 mol·L-1氨水中(溶液的体积保持不变),当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =______;(NH4)2SO3溶液中的质子守恒____________。
=______;(NH4)2SO3溶液中的质子守恒____________。
(2)室温时,向100 mL 0.1 mol·L-1HCl溶液中滴加0.1 mol·L-1氨水,得到溶液pH与氨水体积的关系曲线如图所示:
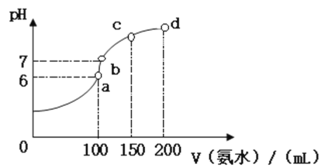
①试分析图中a、b、c、d四个点,水的电离程度最大的是_________;
②在b点,溶液中各离子浓度由大到小的排列顺序是___________;
③写出a点混合溶液中下列算式的精确结果(不能近似计算):c(Cl-)- c(NH4+)=____________,c(H+)- c(NH3·H2O)=____________;
(3)亚硝酸(HNO2)的性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11。常温下向含有2mol碳酸钠的溶液中加入含1mol HNO2的溶液后,溶液中CO32-、HCO3-和NO2-的浓度由大到小的顺序是______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. HClO、H2CO3、HNO3、HClO4的酸性依次增强
B. 苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C. HCl、NH3、C2H5OH均易溶于水的原因之一是与H2O分子均形成氢键
D. 以极性键结合的分子不一定是极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com