
科目:高中化学 来源: 题型:
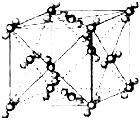 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态.通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如图所示.E的电负性在该周期中最大.镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料.查看答案和解析>>
科目:高中化学 来源: 题型:
碳元素是形成单质及其化合物种类最多的元素。回答下列有关问题。
(1)碳元素可形成多种不同形式的单质,下列是几种单质的结构图
a b
c
观察上述结构,判断a中碳原子的杂化方式为 ,b对应的物质是 ,
c是C60的分子结构模型,在每个C60分子中形成的σ键数目为 。
(2)在C60单质中,微粒之间的作用力为 ,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1∶3,则K3C60属于 晶体。
(3)CO是碳元素的常见氧化物,分子中C原子上有一对孤对电子,与N2互为等电子体,则CO的结构式为 ;写出另一与CO互为等电子体的化学式 。
(4)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4 的结构为 ;写出基态Ni原子的电子排布式 。
(5)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
(6)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,CH4分子存在于H2O分子形成的笼子中(如右图所示)。两种分子中,共价键的键能 ;CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省海门市高二下学期期末教学质量调研化学试题 题型:填空题
碳元素是形成单质及其化合物种类最多的元素。回答下列有关问题。
(1)碳元素可形成多种不同形式的单质,下列是几种单质的结构图
a  b
b  c
c 
观察上述结构,判断a中碳原子的杂化方式为 ,b对应的物质是 ,
c是C60的分子结构模型,在每个C60分子中形成的σ键数目为 。
(2)在C60单质中,微粒之间的作用力为 ,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1∶3,则K3C60属于 晶体。
(3)CO是碳元素的常见氧化物,分子中C原子上有一对孤对电子,与N2互为等电子体,则CO的结构式为 ;写出另一与CO互为等电子体的化学式 。
(4)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4的结构为 ;写出基态Ni原子的电子排布式 。
(5)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特 点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。
(6)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,CH4分子存在于H2O分子形成的笼子中(如右图所示)。两种分子中,共价键的键能 ;CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省海门市高二下学期期末教学质量调研化学试题 题型:填空题
碳元素是形成单质及其化合物种类最多的元素。回答下列有关问题。
(1)碳元素可形成多种不同形式的单质,下列是几种单质的结构图
a  b
b  c
c 
观察上述结构,判断a中碳原子的杂化方式为 ,b对应的物质是 ,
c是C60的分子结构模型,在每个C60分子中形成的σ键数目为 。
(2)在C60单质中,微粒之间的作用力为 ,C60能与金属钾化合生成具有超导性的K3C60,在K3C60中阴阳离子个数比为1∶3,则K3C60属于 晶体。
(3)CO是碳元素的常见氧化物,分子中C原子上有一对孤对电子,与N2互为等电子体,则CO的结构式为 ;写出另一与CO互为等电子体的化学式 。
(4)CO可以和很多过渡金属形成配合物。金属镍粉在CO气流中轻微地加热,可生成液态的Ni(CO)4,用配位键表示Ni(CO)4 的结构为 ;写出基态Ni原子的电子排布式 。
(5)科学发现,C和Ni、Mg元素的原子形成的晶体也具有超导性,其晶胞的结构特点如右图,则该化合物的化学式为 ; C、Ni、Mg三种元素中,电负性最大的是 。

(6)碳的氢化物甲烷在自然界中广泛存在,其中可燃冰是有待人类开发的新能源。可燃冰是一种笼状结构,CH4分子存在于H2O分子形成的笼子中(如右图所示)。两种分子中,共价键的键能 ;CH4分子与H2O分子的分子量相差不大,但两种物质的熔沸点相差很大,其主要原因是 。

查看答案和解析>>
科目:高中化学 来源: 题型:
 (10分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。E的电负性在该周期中最大。镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
(10分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F。其中B、D、F原子最外电子层的P能级(轨道)上的电子处于半满状态。通常情况下,A的一种氧化物分子为非极性分子,其晶胞结构如右下图所示。E的电负性在该周期中最大。镓(Ga)与元素B形成的一种化合物是继以C单质为代表的第一代半导体材料和GaF为代表的第二代半导体材料之后,在近10年迅速发展起来的第三代新型半导体材料。
试回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)基态Ga原子的核外电子排布式为 。
(2)A、B、C的第一电离能由大到小的顺序为 。
(3)B元素的单质分子中有 个π键。
(4)上述A的氧化物分子中心原子采取______杂化,其晶胞中微粒间的作用力为 。
(5)FH3沸点与比BH3 (填“高”或“低”),原因是 。
(6)固体CrE3?6H2O溶于水可能有几种不同组成的配离子,实验将含0.2665gCrE3?6H2O的溶液通过H-离子交换树脂(只交换配阳离子),交换出的酸用0.125mol/L的氢氧化钠溶液8.00mL中和。已知配离子配位数为6,则该配离子是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com