
(12分)丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) = 6CO(g) + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)反应C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l)的 △H=
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)
 CO2(g)
+ H2(g) △H1= + 41.2kJ/mol
CO2(g)
+ H2(g) △H1= + 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= ,此过程吸收的热量为________________________.
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2—。在电池内部O2—由____极移向____极(填“正”或“负”);电池的负极电极反应式为 。
(4)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为____ 。
(1)-2219.9kJ/mol(2分) (2)0.16mol/L•min-1 (2分), 32.96kJ(2分)
(3)正(1分),负(1分), C3H8 + 10O2- -20e- =3CO2 +4H2O(2分)
(4)有无色气体生成,有白色沉淀生成。(2分)
【解析】(1)根据盖斯定律可知,(①+②×3)÷2,即得到C3H8(g) +5O2(g) = 3CO2(g) +4H2O(l),所以反应热是△H=(-2741.8kJ/mol-566kJ/mol×3)÷2=-2219.9kJ/mol。
(2)反应速率通常用单位时间内浓度的变化量来表示,所以氢气的反应速率是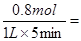 0.16mol/L•min-1 ;根据热化学方程式可知,吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
0.16mol/L•min-1 ;根据热化学方程式可知,吸热的热量是41.2kJ/mol×0.8mol=32.96kJ。
(3)原电池中阳离子向正极移动,阴离子向负极移动。负极失去电子,所以丙烷在负极通入,则负极方程式为C3H8 + 10O2- -20e- =3CO2 +4H2O。
(4)电解池中阴极是得到电子的,所以溶液中的氢离子在阴极放电生成氢气,从而破坏了阴极周围水的电离平衡,产生OH-,所以阴极还产生白色沉淀氢氧化镁。


科目:高中化学 来源:2013-2014学年湖北省孝感市高三第二次统考理综化学试卷(解析版) 题型:填空题
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) +7O2(g) = 6CO(g)+8H2O(g)?? △H = -2389.8 kJ/mol
②2CO(g) + O2(g) = 2CO2(g)????????????? △H = -566 kJ/mol
③H2O(l) = H2O(g)???? △H = + 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式???????????????????????????????????????????? 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭
容器中,在一定条件下发生如下可逆反应: CO(g) +? H2O(g) CO2(g) +? H2(g)
CO2(g) +? H2(g)
该反应的平衡常数与温度的关系如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| H2O | CO | CO2 | H2 |
甲 (质量/g) | 1.8 | 8.4 | a | 1 |
乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是????????????????? ;达到平衡
时,乙容器中CO的转化率为???????? 。
②如图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是???????????????????????????? 、??????????????????? (答两个要点即可)。

(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ?????????? ??? ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时, 溶液中c(HCO3-)∶c(CO32-) = ?????????? 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) - c(H+ ) = ?????????????????????? [用含c(HCO3-)、c(H2CO3)的符号表示]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com