
【题目】下列图像能说明或反映其对应关系的是( )
|
|
|
|
A | B | C | D |
A.第二周期元素的化合价变化
B.第ⅦA族元素简单阴离子的半径变化
C.向50 mL 0.5mol·L-1NaOH溶液中逐滴加入等浓度盐酸时溶液的pH变化
D.Al与稀硫酸反应产生H2的体积变化
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列4种重要的有机物:
①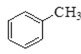 ②
②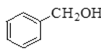 ③
③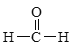 ④
④![]()
请回答:
(1)能与苯酚缩合成高分子化合物的是__________。(填序号)。
(2)能使酸性高锰酸钾溶液褪色的是__________。(填序号)。
(3)写出④在一定条件下发生消去反应的化学方程式__________。
Ⅱ.2020年3月22日为第28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_____。(填“锌块”或“铜块”)
(2)自来水厂常用含有Fe3+的净水剂净水,其原理是______。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,Cl2+H2OHCl+HClO,要增大HClO的浓度,可以加入下列物质中的__________。
A.NaOH B.浓HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH)=______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )

A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄酮类化合物具有抗肿瘤活性,6-羟基黄酮衍生物的合成路线如下:
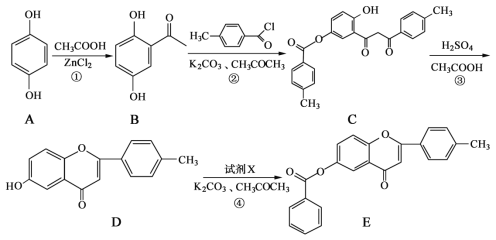
请回答下列问题:
(1)化合物B中的含氧官能团为__________和_____________(填名称)。
(2)反应③中涉及到的反应类型有水解反应、_____________和_____________。
(3)反应④中加入的试剂X的分子式为C7H5OCl,X的结构简式为________________。
(4)B的一种同分异构体满足下列条件,写出该同分异构体的结构简式:___________________
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有4种不同化学环境的氢。
(5)已知: 。根据已有知识并结合相关信息,写出以
。根据已有知识并结合相关信息,写出以![]() 和CH3COOH为原料制备
和CH3COOH为原料制备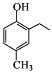 的合成路线流程图(无机试剂任选)__________。合成路线流程图示例:
的合成路线流程图(无机试剂任选)__________。合成路线流程图示例:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能获得成功的是( )
A.将乙醛滴入银氨溶液中,加热煮沸制银镜
B.将1-氯丙烷与NaOH溶液共热几分钟后,冷却、加入过量稀硝酸酸化,滴加AgNO3溶液,得白色沉淀,证明其中含有氯元素
C.苯与浓溴水反应制取溴苯
D.![]() 溶液
溶液![]() 和
和![]() 溶液
溶液![]() 混合后加入
混合后加入![]() 的乙醛溶液
的乙醛溶液![]() ,加热煮沸观察沉淀的颜色
,加热煮沸观察沉淀的颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙炔酸甲酯(![]() )是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为
)是一种重要的有机化工原料,沸点为103~105 ℃。实验室制备少量丙炔酸甲酯的反应为 ![]() +CH3OH
+CH3OH![]()
![]() +H2O
+H2O
实验步骤如下:
步骤1:在反应瓶中,加入14 g丙炔酸、50 mL甲醇和2 mL浓硫酸,搅拌,加热回流一段时间。
步骤2:蒸出过量的甲醇。
步骤3:反应液冷却后,依次用饱和NaCl溶液、5%Na2CO3溶液、水洗涤。分离出有机相。
步骤4:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙炔酸甲酯。
(1)步骤1中,加入过量甲醇的目的是________。
(2)步骤3中,用5%Na2CO3溶液洗涤,主要除去的物质是_______;分离出有机相的操作名称为__________。
(3)步骤4中,蒸馏时不能用水浴加热的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸和一水合氨是重要的弱酸和弱碱,常温下,其电离常数如下表所示。回答下列问题:
弱电解质 | H2CO3 | NH3·H2O | |
电离常数 |
|
|
|
(1)碳酸的一级电离方程式为______,二级电离常数表达式![]() ________。
________。
(2)浓度均为0.01 mol.L-1的H2CO3溶液和NH3·H2O溶液等体积混合,混合溶液中的溶质是_______(写化学式),混合溶液中![]() 、
、![]() 、
、![]() 、
、![]() 的浓度由大到小的顺序是_______。
的浓度由大到小的顺序是_______。
(3)![]() 和
和![]() 在水溶液中相互促进水解,反应为
在水溶液中相互促进水解,反应为![]() ,则常温下,该反应的平衡常数
,则常温下,该反应的平衡常数![]() _______。(保留2位有效数字)。
_______。(保留2位有效数字)。
(4)室温下,向100 mL 0.2 mol.L-1NaHCO3溶液中加入100 mL 0.2 mol·L-1NH3·H2O溶液,则![]() +____+_____。
+____+_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1LpH=10的NaOH溶液中持续通入CO2。通入的CO2的体积(V)与溶液中水电离出的OH-离子浓度(φ)的关系如图所示。下列叙述正确的是
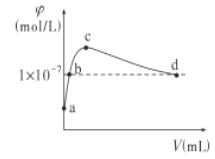
A.a点溶液中:水电离出的c(H+)=1×10-10mol/L
B.b点溶液中:n(Na+)=1×10-10mol
C.c点溶液中:c(Na+)>c(![]() )>c(
)>c(![]() )
)
D.d点溶液中:c(Na+)=2c(![]() )+c(
)+c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,能使电离平衡H2O![]() H+ + OH-正向移动且溶液呈酸性的是( )
H+ + OH-正向移动且溶液呈酸性的是( )
A. 向水中加入NaHSO4溶液 B. 向水中加入Al2(SO4)3溶液
C. 向水中加入Na2CO3溶液 D. 将水加热到100℃,使水的pH=6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com