
下列各组物质的性质比较,正确的是( )
| A.熔点:CO2<H2O<SiO2<KCl |
| B.粒子半径:K+>Na+>Mg2+>Al3+ |
| C.酸性:H3PO4>H2SO4>HClO4>H2SiO3 |
| D.稳定性:H2O<NH3<PH3<SiH4 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
图表法、图象法是常用的科学研究方法。
(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第 族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是: (填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期金属元素甲~戊在元素周期表中的相对位置如表中所示。下列判断正确的是
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
| B.CH4、NH3、PH3的热稳定性逐渐增强 |
| C.因为酸性:HC1>HF,所以非金属性:Cl>F |
| D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.镁、铝、铜、铁、钠五种元素中,铜和铁均为副族元素 |
| B.10Be和9Be是中子数不同质子数相同的同种核素 |
| C.元素X位于元素Y的上一周期,X原子得电子能力强于Y原子 |
| D.短周期的同主族元素原子序数差值可能为2、8、10 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y 元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
| A.Y可用于制造高性能可充电电池 |
| B.WX3的沸点高于ZX3 |
| C.Z的最高价含氧酸的酸性强于W的最高价含氧酸的酸性 |
| D.原子半径的大小顺序:rW>rZ>rY>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法下正确的是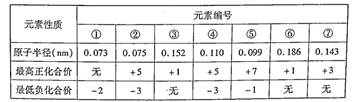
| A.⑦的简单离子不是同周期元素离子半径最小的 |
| B.气态氢化物的稳定性①>② |
| C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏 |
| D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲是周期表中原子半径最小的元素,乙形成的气态氢化物的水溶液呈碱性,乙与丁同族,丙、丁、戊同周期,丙单质可制成半导体材料,戊的最高化合价为+7,则
| A.原子半径:乙>丁>丙 |
| B.非金属性:丙>丁>戊 |
| C.甲与戊形成的化合物是共价化合物 |
| D.乙、丙、丁最高价氧化物对应的水化物均是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
| A.XH4的沸点比YH3高 |
| B.X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
| C.元素W的最高价氧化物对应水化物的酸性比Y的强 |
| D.X与Y形成的化合物的熔点可能比金刚石高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com