
【题目】处于平衡状态的反应:2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
A.加入催化剂,反应途径将发生改变,ΔH也将随之改变
B.升高温度,正、逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2的浓度将减小
【答案】B
【解析】
A. 加入催化剂,反应速率加快,反应的活化能降低;
B. 升高温度,反应速率加快,平衡向吸热的方向移动;
C. 增大压强,平衡向体积缩小的方向移动;
D. 增大生成物的浓度,平衡移向移动。
A.加入催化剂,反应途径将发生改变,但根据盖斯定律反应的始态和终态不变,反应的ΔH不会改变,A项错误;
B.升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,所以平衡正向移动,H2S分解率增大,B项正确;
C.该反应随反应进行气体分子数增多,增大压强,化学平衡逆向移动,由于正反应吸热,所以平衡逆向移动体系温度升高,C项错误;
D.恒容体系中充入H2平衡逆向移动,但平衡移动的趋势是很微弱的,只能减弱这种改变,不能抵消这种改变,因此再次平衡时H2的浓度比原来的大,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下表中的各组物质之间通过一步反应就能实现如图所示转化的是( )
编号 | a | b | c | d |
|
① | Na2O | Na2O2 | Na | NaOH | |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | MgO | MgCl2 | Mg | Mg(OH)2 |
A.①②④B.①③④C.①②③D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物质的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑色粉末A,黄色粉末B,它们都是单质,按下图进行实验:
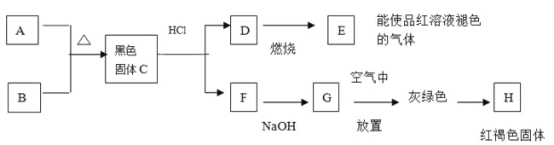
(1) 试根据上述反应现象推断以下物质的化学式:
A D E H
(2)写出C+盐酸![]() D+F的离子方程式:
D+F的离子方程式:
(3)写出D![]() E的化学方程式:
E的化学方程式:
(4)写出G![]() H的化学方程式:
H的化学方程式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁、铝混合物投到2 mol·L-1的盐酸中,待金属完全溶解后,向溶液中加入2 mol·L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
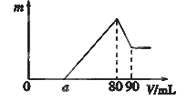
(1)80-90ml对应反应的离子方程式_____________;
(2)金属铝的质量为____________g;
(3)盐酸的体积是____________mL;
(4)a的取值范围是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42—等杂质离子,实验室提纯NaCl的流程如下:
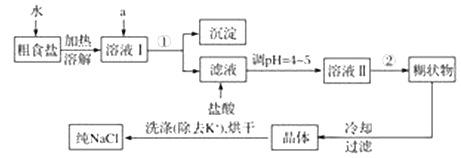
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇。
(1)在过滤过程中所需要的玻璃仪器有________________________________________。
(2)欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42—,选出a所代表的试剂,按滴加顺序依次为_______(只填化学式)。
(3)用于沉淀的试剂需过量,否则不能将杂质除尽,检验过滤的滤液中是否含有Fe3+的方法__________,过滤所得沉淀需要洗涤,洗涤沉淀的方法__________________。
(4)用提纯的NaCl配制成480ml 0.2molL-1的NaCl溶液,用托盘天平称取___________ g纯的NaCl晶体,用蒸馏水在_______________中溶解,完全溶解后,全部转移至________________中,加蒸馏水至______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
A. v(A)=0.15 mol·L-1·min-1B. v(B)=0.01 mol·L-1·s-1
C. v(C)=0.40 mol·L-1·min-1D. v(D)=0.45 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛应用于航空工业。从银铜合金的切割废料中回收银和制备CuAlO2的流程
如下。
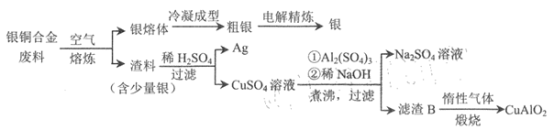
已知:Al(OH) 3和Cu(OH) 2开始分解的温度分别为450℃和 80℃。 下列说法错误的是
A.电解精炼时,粗银做阳极,纯银做阴极
B.为提高原料利用率,流程中应加过量的稀NaOH
C.滤渣B煅烧时发生的反应为 4CuO+4Al(OH)3![]() 4CuA1O2+ O2↑+6H2O
4CuA1O2+ O2↑+6H2O
D.若用 1.0 kg 银铜合金(铜的质量分数为64%) 最多可生成 10.0mol CuA1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com