
【题目】大气中的氮氧化物(NOx)、CO、CO2、SO2 等的含量低高是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
(1)汽车发动机工作时会引发N2和O2反应。已知:N2中氮氮键的键能是946kJ/mol,O2中氧氧键的键能是498kJ/mol,NO中氮氧键的键能是632kJ/mol。则N2和O2反应生成NO的热化学方程式为_____________。
(2)用CH4催化还原NOx可以消除污染:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l)。若该反应在恒温恒容容器中达到平衡,下列叙述能作为判断反应达到平衡状态标志的是_____(填标号)。
N2(g)+CO2(g)+2H2O(l)。若该反应在恒温恒容容器中达到平衡,下列叙述能作为判断反应达到平衡状态标志的是_____(填标号)。
A.容器中的压强保持不变
B.容器中氮元素的质量分数不再变化
C.混合气体的平均相对分子质量不再变化
D.n(CH4):n(NO2):n(N2):n(CO2):n(H20)=1:2: 1: 1: 2
(3)为减少CO、CO2对环境造成的影响,采用以下方法将其资源化利用。
①在铝矾土作催化剂、773K条件下,3molCO与1.5molSO2反应生成3molCO2和0.75mol硫蒸气,该反应可用于从烟道气中回收硫,写出该反应的化学方程式_________。
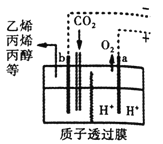
②以CO2为原料采用特殊的电极电解强酸性的CO2水溶液可得到多种燃料,其原理如图所示。电解时其中b极上生成乙烯的电极反应式为_________。
(4)汽车尾气处理催化装置中涉及的反应之一为:2NO(g) +2CO(g)![]() N2(g) +2CO2(g) △H<0
N2(g) +2CO2(g) △H<0
研究表明:在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验编号 | T/K | NO初始浓度/(mol.L-1) | CO初始浓度/(mol.L-1) | 催化剂的比表面积(m2.g-1) |
Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
(注:生成物的起始浓度为0mol/L)
根据下图回答:
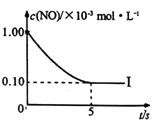
①实验I前5s内用N2 表示的反应速率为________。
②实验I反应的平衡常数KI=_______。
③在图中画出上表中实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势(标明各条曲线的实验编号) _____。
【答案】 N2(g)+O2(g)=2NO(g) △H=+180 kJ/mol A 4CO+2SO2 ![]() 4CO2+S2 2CO2+12H++12e-=C2H4+4H2O 9×10-5mol/(Ls) 5×103
4CO2+S2 2CO2+12H++12e-=C2H4+4H2O 9×10-5mol/(Ls) 5×103 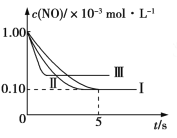
【解析】(1)化学反应的焓变等于反应物的总键能减去生成物的总键能,反应为:N2(g)+O2(g)=2NO(g),所以焓变为:946+498-2×632=180kJ/mol,所以热化学方程式为:N2(g)+O2(g)=2NO(g) △H=+180 kJ/mol。
(2)恒容恒温下,容器的压强不变就是气体的总物质的量不变,该反应为气体物质的量减小的反应(水为液态),所以压强不变能说明反应达平衡,选项A正确。根据质量守恒定律,反应中氮元素的总质量和整个体系的总质量都不变,所以氮元素的质量分数不变不能说明反应达平衡,选项B错误。甲烷和二氧化氮是按照物质的量之比为1:2反应的,所以反应的气体的平均分子量为:(16+46×2)÷3=36;生成物为1:1的氮气和二氧化碳(水为液体),其平均分子量为:(28+44)÷2=36;所以说明如果按照1:2的比例关系加入甲烷和二氧化氮反应,体系的平均分子量将一直是36,此时平均分子量不变不能说明反应达平衡,选项C错误。选项D中的比例关系不说明反应达平衡,原因是这个比例关系可能是瞬间达到的结果,过了这个时刻,这个比例就变化了,即应该加上“不再变化”才能说明反应达平衡,选项D错误。
(3)①3molCO与1.5molSO2反应生成3molCO2和0.75mol硫蒸气,从而得到四种物质的比例为4:2:4:1,如果生成的是S明显看出方程式中的S不守恒,所以只能认为生成的硫蒸气为S2,得到4CO+2SO2![]() 4CO2+S2。
4CO2+S2。
②从图中得到b电极的反应物为CO2,溶液应该显酸性,题目要求写生成乙烯(C2H4)的反应,所以得到反应片段:CO2 + H+ →C2H4。CO2中C为+4价,C2H4中C为-2价,所以反应应该得电子,一个C得到6个电子,补充反应片段为:2CO2 + H+ +12e- → C2H4。再根据原子个数守恒和电荷守恒得到反应为:2CO2+12H++12e-=C2H4+4H2O。
(4)①从图中得到前5s的![]() ,由方程式得到N2的速率是NO速率的一半,所以
,由方程式得到N2的速率是NO速率的一半,所以![]() 。
。
②根据题目数据得到:2NO(g) + 2CO(g) ![]() N2(g) + 2CO2(g) △H<0
N2(g) + 2CO2(g) △H<0
起始: 1×10-3 3.6×10-3 0 0
反应: 0.9×10-3 0.9×10-3 0.45×10-3 0.9×10-3
平衡: 0.1×10-3 2.7×10-3 0.45×10-3 0.9×10-3
所以KⅠ![]() 。
。
③实验Ⅱ与实验Ⅰ相比较,催化剂的比表面积大,所以反应的速率快,但是平衡态不变,即反应达到平衡需要的时间较短,但是达平衡时的NO浓度不变。实验Ⅲ与实验Ⅱ相比较,反应的温度较高,所以速率快达到平衡需要的时间较短,升高温度平衡逆向移动,达到平衡时的NO的浓度增加,所以图像为: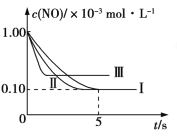 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列关于元素周期表叙述不正确的是
A.短周期为第1、2、3周期
B.ⅠA族都是金属元素
C.元素周期表中有7个主族
D.可根据元素在周期表中位置预测其性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是一种重要的化工原料。下列物质中,不能通过乙烯的加成反应一步制得的是( )
A.CH3COOHB.CH3CH2OHC.CH3CH2ClD.CH2BrCH2Br
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中两条曲线分别表示1g C3H6气体、1g M气体在相同体积的容器中压强和温度的关系,试根据图判断M气体可能是

A.PH3 B.N2 C.C3H4 D.N2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. AlN中氮的化合价为-3 B. 上述反应中,每消耗1 mol N2需转移3 mol电子
C. AlN的摩尔质量为41 g D. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的叙述正确的是( )
A.导电性很强的物质
B.在溶于水或熔融状态下能导电的化合物
C.在溶于水和熔融状态下均电离的化合物
D.可溶性盐类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用键能的大小来解释的是 ( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生化学反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是 ( )
A. 铜铸塑像上出现铜绿[Cu2(OH)2CO3] B. 充有氢气的气球遇明火爆炸
C. 大理石雕像被酸雨腐蚀毁坏 D. 铁质菜刀生锈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人类重要的营养物质。下列有关这三类物质的说法正确的是
A.均是天然高分子化合物B.均只由C、H、O三种元素组成
C.蛋白质是热值最高的营养物质D.淀粉、油脂、蛋白质在一定条件下均能发生水解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com