
【题目】日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是 ( )
A. 铜铸塑像上出现铜绿[Cu2(OH)2CO3] B. 充有氢气的气球遇明火爆炸
C. 大理石雕像被酸雨腐蚀毁坏 D. 铁质菜刀生锈
【答案】C
【解析】
氧化还原反应的特征是:有元素化合价的升降,据此分析。
A.铜铸塑像上出现铜绿是因为空气中O2、水蒸气、CO2与铜发生化学反应的结果:2Cu+O2+H2O+CO2=Cu2(OH)2CO3,反应中铜元素化合价升高,O2中氧元素化合价降低,该反应属于氧化还原反应,A项错误;
B.氢气气球遇明火爆炸,发生的反应是:2H2+O2![]() 2H2O,氢元素化合价升高,氧元素化合价降低,该反应属于氧化还原反应,B项错误;
2H2O,氢元素化合价升高,氧元素化合价降低,该反应属于氧化还原反应,B项错误;
C.大理石的主要成分是CaCO3,与酸雨反应:CaCO3+2H+=Ca2++CO2![]() +H2O,此反应中没有元素化合价的升降,该反应不属于氧化还原反应,C项正确;
+H2O,此反应中没有元素化合价的升降,该反应不属于氧化还原反应,C项正确;
D.铁质菜刀生锈,是铁与空气中O2、水蒸气共同作用的结果:2Fe+![]() O2+xH2O=Fe2O3
O2+xH2O=Fe2O3![]() xH2O,铁元素化合价升高,O2中氧元素化合价降低,该反应属于氧化还原反应,D项错误;答案选C。
xH2O,铁元素化合价升高,O2中氧元素化合价降低,该反应属于氧化还原反应,D项错误;答案选C。


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Mg2+、Ba2+、Cl-、HCO3-中的一种或几种离子。为确定其成分,进行以下实验:
实验1:取10mL无色溶液,滴加适量稀盐酸无明显现象。
实验2:另取10mL无色溶液,加入足量的Na2SO4溶液,有白色沉淀生成。
实验3:将实验1后的溶液于锥形瓶中,向锥形瓶中逐滴加入NaOH溶液,滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如右图所示。

回答下列问题:
(1)原溶液中不存在的离子有__________,存在的离子有________________。检验存在的阴离子的方法是________________________________________
(2)实验3中,图像中OA段反应的离子方程式为____________________________。
(3)根据图像计算原溶液中Mg2+的物质的量浓度_______。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中的氮氧化物(NOx)、CO、CO2、SO2 等的含量低高是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
(1)汽车发动机工作时会引发N2和O2反应。已知:N2中氮氮键的键能是946kJ/mol,O2中氧氧键的键能是498kJ/mol,NO中氮氧键的键能是632kJ/mol。则N2和O2反应生成NO的热化学方程式为_____________。
(2)用CH4催化还原NOx可以消除污染:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(l)。若该反应在恒温恒容容器中达到平衡,下列叙述能作为判断反应达到平衡状态标志的是_____(填标号)。
N2(g)+CO2(g)+2H2O(l)。若该反应在恒温恒容容器中达到平衡,下列叙述能作为判断反应达到平衡状态标志的是_____(填标号)。
A.容器中的压强保持不变
B.容器中氮元素的质量分数不再变化
C.混合气体的平均相对分子质量不再变化
D.n(CH4):n(NO2):n(N2):n(CO2):n(H20)=1:2: 1: 1: 2
(3)为减少CO、CO2对环境造成的影响,采用以下方法将其资源化利用。
①在铝矾土作催化剂、773K条件下,3molCO与1.5molSO2反应生成3molCO2和0.75mol硫蒸气,该反应可用于从烟道气中回收硫,写出该反应的化学方程式_________。
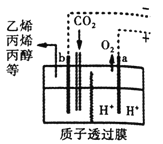
②以CO2为原料采用特殊的电极电解强酸性的CO2水溶液可得到多种燃料,其原理如图所示。电解时其中b极上生成乙烯的电极反应式为_________。
(4)汽车尾气处理催化装置中涉及的反应之一为:2NO(g) +2CO(g)![]() N2(g) +2CO2(g) △H<0
N2(g) +2CO2(g) △H<0
研究表明:在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验编号 | T/K | NO初始浓度/(mol.L-1) | CO初始浓度/(mol.L-1) | 催化剂的比表面积(m2.g-1) |
Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
(注:生成物的起始浓度为0mol/L)
根据下图回答:
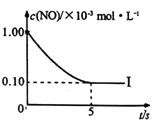
①实验I前5s内用N2 表示的反应速率为________。
②实验I反应的平衡常数KI=_______。
③在图中画出上表中实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势(标明各条曲线的实验编号) _____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面关于电解质的叙述中错误的是( )
A.在水溶液中和熔融状态下均不导电的化合物叫非电解质
B.电解质、非电解质都指化合物而言,单质不属于此范畴
C.电解质在水中一定能导电,在水中导电的化合物一定是电解质
D.纯水的导电性很差,但水也是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是_________,CO的体积分数是_________,混合气体的平均摩尔质量是____________。
(2) 1.15g金属钠跟水反应,得到100mL溶液,试计算:
①生成的气体在标准状况下是_________________
②反应后所得溶液的物质的量浓度是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示。其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+![]() Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是( )
Fe3++OH-+·OH,生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法中正确的是( )
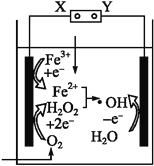
A. 电源的X极为正极,Y极为负极
B. 阴极的电极反应式为Fe2+-e-![]() Fe3+
Fe3+
C. 每消耗1molO2,整个电解池中理论上可产生2mol·OH
D. 阳极的电极反应式为H2O-e-![]() H++·OH
H++·OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列有关化学用语不正确的是( )
A. 钠离子的电子式:Na+ B. Cl—的结构示意图:![]()
C. 氖气的化学式:Ne D. 质量数为18的氧原子:818O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在工农业生产中都有重要应用。
(1)氨和肼(N2H4)是两种最常见的氮氢化物。
己知:4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为_________,该反应的化学平衡常数K=____(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为_________,该反应的化学平衡常数K=____(用K1、K2表示)。
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是____(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆 D.容器中混合气体的平均摩尔质量不变
②图1为容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)= ____,平衡时NO的转化率为____。
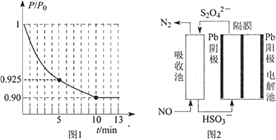
(3)使用间接电化学法可处理燃煤烟气中的NO,装置如图2所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式_________。用离子方程式表示吸收池中除去NO的原理__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是( )
A. 采用电解水法制取氢气作为新能源 B. 完善煤液化制取汽油的技术
C. 研制推广以甲醇为燃料的汽车 D. 进一步提高石油加工工艺
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com