
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
分析 A.二氧化硫与品红化合生成无色物质;
B.由阳离子、阴离子离子构成的化合物化合物是离子化合物,一般由活泼金属和活泼非金属元素组成;
C.Fe与稀HNO3反应生成NO;
D.HCl、NH3均极易溶于水.
解答 解:A.二氧化硫与品红化合生成无色物质,体现其漂白性,而Cl2能使品红溶液褪色,说明其氧化性,故A错误;
B.氯化氢是共价化合物,故B错误;
C.Fe与稀HNO3反应生成NO,该反应不是置换反应,Fe与稀H2SO4反应有氢气生成,属于置换反应,故C错误;
D.HCl、NH3均极易溶于水,则分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,故D正确.
故选D.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物知识,把握物质的性质及发生的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 相关实验 | 预期目的 | |
| ① | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中.观察气泡快慢; | 验证温度对化学反应速率的影响. |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | 仅① | B. | ①④ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
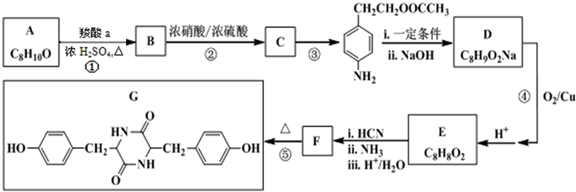
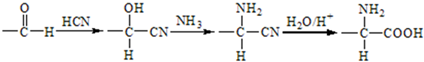
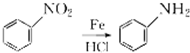
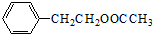 +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$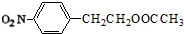 +H2O.
+H2O.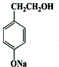 .
.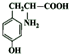 .
.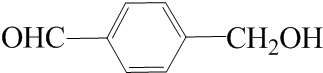 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | KNO3溶液中混有少量K2SO4,加入适量BaCl2溶液 | |
| B. | 二氧化碳气体中混有少量二氧化硫:通入酸性高锰酸钾溶液,收集气体 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
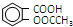 )是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸(
)是世界上应用最广泛的解热、镇痛药.因乙酸很难与酚羟基酯化,工业上以水杨酸(  )与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下:
)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林.粗产品中主要的副产物是水杨酸多聚物,需进一步提纯.反应原理和相关物理数据如下: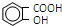 +(CH3CO)2O$?_{△}^{浓硫酸}$
+(CH3CO)2O$?_{△}^{浓硫酸}$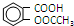 +CH3COOH
+CH3COOH| 名称 | 常温下状态 | 水中溶解性 |
| 乙酸酐 | 液 | 与水反应 |
| 阿司匹林 | 固 | 冷水中微溶;热水中易溶 |
| 水杨酸多聚物 | 固 | 难溶 |

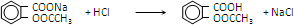 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
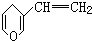 互为同分异构体,其中与FeCl3溶液混合后显色和不显色的种类分别有( )
互为同分异构体,其中与FeCl3溶液混合后显色和不显色的种类分别有( )| A. | 2种和1种 | B. | 2种和3种 | C. | 3种和2种 | D. | 3种和1种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com