
【题目】25 ℃时,将SO2通入NaOH溶液得到一组c(H2SO3)+c(HSO3-)+c(SO32-)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如右下图所示。下列叙述正确的是
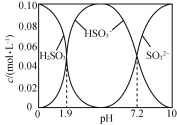
A.H2SO3的Ka2=10-7.2
B.pH=1.9的溶液中:c(Na+)>c(H2SO3)=c(HSO3-)> c(SO32-)
C.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
D.c(HSO3-)=0.050 mol·L-1的溶液中:c(H+)+c(Na+)<0.150 mol·L-1+c(OH-)
【答案】AD
【解析】
A.当pH=7.2时,c(H+)=10-7.2mol/L,c(SO32-)=c(HSO3-),H2SO3的二级电离方程式为:HSO3-H++SO32-,Ka2=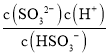 = c(H+)=10-7.2,故A正确;
= c(H+)=10-7.2,故A正确;
B.根据图示,pH=1.9时,溶液中不含SO32-,故B错误;
C.溶液中存在电荷守恒:c(Na+)+ c(H+)= 2c(SO32-)+ c(HSO3-)+ c(OH-),c(Na+)=0.100 mol·L-1时,c(H2SO3)+c(HSO3-)+c(SO32-)=c(Na+),代入电荷守恒式中可得:c(H+)+c(H2SO3)=c(OH-)+c(SO32-),故C错误;
D.根据c(H2SO3)+c(HSO3-)+c(SO32-)=0.100 mol·L-1,溶液中的c(HSO3-)=0.050 mol·L-1,则c(H2SO3)+c(SO32-)=0.05mol·L-1,溶液中存在电荷守恒:c(Na+)+ c(H+)= 2c(SO32-)+ c(HSO3-)+ c(OH-)=2×(0.05mol·L-1- c(H2SO3))+ 0.05mol·L-1+ c(OH-)= 0.150 mol·L-1+c(OH-)-2 c(H2SO3),则c(H+)+c(Na+)<0.150 mol·L-1+c(OH-),故D正确;
答案选AD。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.反应2HI(g)![]() H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
C.合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率
D.用HCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种特殊的热激活电池示意图如下。该电池总反应为:PbSO4(s)+2LiCl+Ca(s)= CaCl2(s)+ Li2SO4+Pb(s) ,下列说法不正确的是
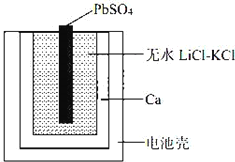
A. Ca电极发生氧化反应
B. 负极的电极反应:Ca(s)+2Cl﹣﹣2e﹣= CaCl2(s)
C. 可用 LiCl 和 KCl 水溶液代替无水 LiCl﹣KCl
D. 当无水LiCl﹣KCl混合物受热熔融后电池才能工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B、C为原料制取药物AspirinSustained-ReleaseTablets(缓释阿司匹林)的合成路线如图:

已知:ⅰ.A、B为烃,其中A的产量可作为石油化工水平的标志;
ⅱ. 。
。
回答下列问题:
(1)Z所含官能团名称为___。
(2)B和Y的结构简式为__、__。
(3)完成方程式:
①X→CH2OHCH2OH__。
②C→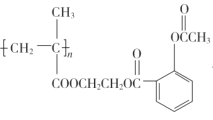 __。
__。
(4)满足以下条件的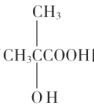 的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
a.能发生水解反应 b.能与钠反应放出氢气 c.能发生银镜反应
(5)以乳酸(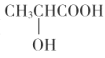 )和甲醇为原料,其他无机试剂任选,设计合成
)和甲醇为原料,其他无机试剂任选,设计合成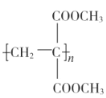 的路线:__。
的路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
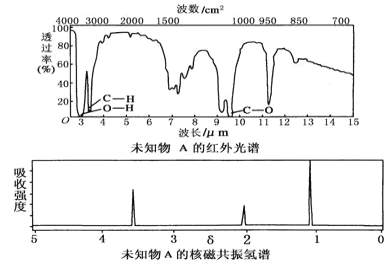
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)镍基态原子的核外电子排布式为________。
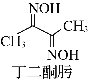
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为________。
(3)与CO互为等电子体的阴离子的化学式为__________________。
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为________。氨的沸点高于膦(PH3),原因是____________________________。
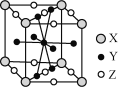
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是
(2)C装置中浓硫酸的作用是 .
(3)D装置中MnO2的作用是 .
(4)燃烧管中CuO的作用是 .
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为 .
(6)用质谱仪测定其相对分子质量,得如图二所示的质谱图,则该有机物的相对分子质量为 .
(7)能否根据A的实验式确定A的分子式 (填“能”或“不能”),若能,则A的分子式是 (若不能,则此空不填).
(8)该物质的核磁共振氢谱如图三所示,则其结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋于缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化为成为有机物实现碳循环。如:
C2H4 (g) + H2O (l) = C2H5OH (l) ΔH=-44.2 kJ·mol-1
2CO2(g) + 2H2O (l) =C2H4 (g) +3O2(g) ΔH=+1411.0 kJ·mol-1
2CO2(g) + 3H2O (l) = C2H5OH (l) + 3O2(g) ΔH=___________
(2)CO2甲烷化反应是由法国化学家Paul Sabatier 提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程:
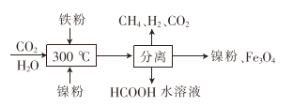
①上述过程中,产生H2反应的化学方程式为:___________________________________。
②HCOOH是CO2转化为CH4的中间体:CO2 ![]() HCOOH
HCOOH ![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉的用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是_______________(填I或II)
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g) + 4H2 (g)![]() CH4 (g) +2H2O(g)
CH4 (g) +2H2O(g)
反应II:2CO2(g) + 6H2 (g)![]() C2H4 (g) +4H2O(g)
C2H4 (g) +4H2O(g)
在1L密闭容器中冲入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。T1℃时,CO2的转化率为_________。T1℃时,反应I的平衡常数K=_______。

(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g) + 6H2 (g)![]() C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=
C2H5OH (g) +4H2O(g) ΔH,m代表起始时的投料比,即m=![]() .
.
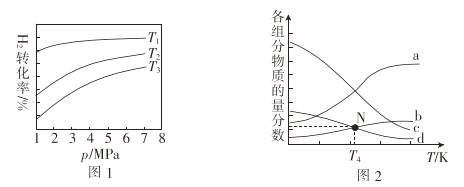
①图1中投料比相同,温度T3>T2>T1,则ΔH_____(填“>”或“<”)0.
②m=3时,该反应达到平衡状态后p(总)=20ɑ MPa ,恒压条件下各物质的物质的量分数与温度的关系如图2.则曲线b代表的物质为_______(填化学式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com