
| A. | 它位于周期表的第四周期、第ⅠA族 | |
| B. | 在钠、钾、铷三种单质中,相同条件下铷与水的反应速率最小 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 硝酸铷是离子化合物 |
分析 A.铷核外有5个电子层,最外层有1个电子;
B.在碱金属元素中,单质的金属性随着原子序数的增大而增大;
C.元素的金属性越强,其相应碱的碱性越强;
D.硝酸铷是由硝酸根离子与铷离子构成.
解答 解:A.Rb位于周期表的第五周期、第ⅠA族,故A错误;
B.碱金属元素中,单质的活泼性随着原子序数的增大而增大,所以在钠、钾、铷中,铷的与水反应剧烈程度增强,在钠、钾、铷三种单质中,相同条件下铷与水的反应速率最大,故B错误;
C.元素的金属性越强,其相应碱的碱性越强,Rb的金属性大于K,KOH是强碱,则RbOH也是强碱,故C错误;
D.硝酸铷是由硝酸根离子与铷离子通过离子键构成的离子化合物,故D正确;
故选D.
点评 本题考查了碱金属元素的性质,明确同周主族元素性质递变规律是解题关键,注意原子结构与元素在周期表中位置的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的性状 | 温度/ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m4 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| B. | 熔点由高到低:SiC>Si>SiO2>Ge | |
| C. | 沸点由高到低:NH3>PH3>AsH3>SbH3 | |
| D. | 晶格能由大到小:NaI>NaBr>NaCl>NaF |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用钢瓶储存液氯或浓硫酸 | |
| B. | 通过灼热的铜网以除去H2中混有的O2 | |
| C. | Cu与浓硫酸反应终止后,冷却,向试管中加适量蒸馏水以观察水合铜离子的颜色 | |
| D. | pH小于7的雨水即为酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
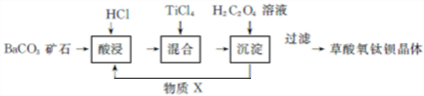
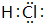 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:正戊烷>2-甲基丁烷>丙烷 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 | |
| D. | 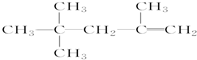 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com