

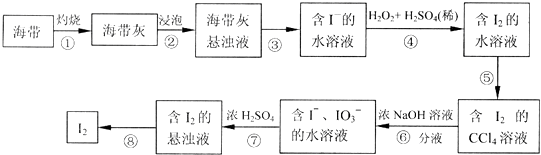
分析 (1)根据实验操作步骤①灼烧来分析用到的实验仪器;
(2)分离固体和液体用过滤;
(3)反应MnO2+2KI+2H2SO4═MnSO4+K2SO4+2H2O+I2中,Mn元素化合价由+4价降低到+2价,I元素化合价由-1价升高到0价,氧化剂是MnO2,氧化产物是I2,根据双线桥法分析.
解答 解:(1)灼烧固体物质一般使用(瓷)坩埚,而坩埚加热需要用泥三脚支撑然后放在三脚架上,三脚架下面的空间放酒精灯,故答案为:B;
(2)将悬浊液分离为残渣和含碘离子溶液应选择过滤的方法,故答案为:过滤;
(3)反应MnO2+2KI+2H2SO4═MnSO4+K2SO4+2H2O+I2中,Mn元素化合价由+4价降低到+2价,I元素化合价由-1价升高到0价,氧化剂是MnO2,氧化产物是I2,反应的离子方程式为MnO2+2I-+4H+═Mn2++2H2O+I2,用双线桥标出电子转移方向和数目为 ,
,
故答案为: ;MnO2;I2;MnO2+2I-+4H+═Mn2++2H2O+I2.
;MnO2;I2;MnO2+2I-+4H+═Mn2++2H2O+I2.
点评 本题考查制备实验方案的设计,氧化还原反应的表示方法,题目难度中等,注意基本实验操作的要点和注意事项.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol A 与足量的酸反应生成的H2比1 mol B生成的H2多 | |
| B. | A原子电子层数比B原子的电子层数多 | |
| C. | 常温时,A能从水中置换出氢,而B不能 | |
| D. | A原子的最外层电子数比B原子的最外层电子数少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
(I)、某学生用0.100mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它位于周期表的第四周期、第ⅠA族 | |
| B. | 在钠、钾、铷三种单质中,相同条件下铷与水的反应速率最小 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 硝酸铷是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 和锂同一主族的都是金属元素 | B. | LiOH的碱性比NaOH的弱 | ||
| C. | 锂的化学性质不如钠活泼 | D. | Li在空气中燃烧生成Li2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com