
��һ����������Һ��ֻ���ܺ��д�����Fe3+��Fe2+��H+��AlO2����Al3+��CO32����NO3�����������еļ��֣������Һ����μ���һ����1mol/L NaOH��Һ�Ĺ����У���ʼû�г�����������г������������ж���ȷ���ǣ�������
�� A�� ��Һ�п��ܺ���AlO2��
�� B�� ��Һ�п��ܺ���NO3��
�� C�� ��Һ��һ������Fe2+��Fe3+
�� D�� ��Һ�п��ܺ���Fe3+����һ������Fe2+
���㣺 �������ӵļ��鷽����
ר�⣺ ���ӷ�Ӧר�⣮
������ �����Һ�м���һ����1mol/L NaOH��Һ�Ĺ����У���ʼû�г�����˵����Һ�����ԣ���һ�����д�����H+���ӣ���������Һ��AlO2����CO32������������Ӧ����������ʶ����ܴ��ڣ�������г������ܹ����ɳ�������Fe3+���ӡ�Fe2+���ӻ�Al3+�����е�һ�ֻ��֣������Һ�ĵ����Ժ�Fe2+���ӵĻ�ԭ���Լ�NO3�����ӵ�����������һ�����ƶϣ�
��� �⣺�����Һ�м���һ����1mol/L NaOH��Һ�Ĺ����У���ʼû�г�����˵����Һ�����ԣ���һ�����д�����H+���ӣ�
��������Һ��AlO2����CO32�����ӷֱ���H+���ӷ�Ӧ����Al��OH��3������CO2��������ܴ��ڣ�
������Һ�ĵ����Կ�֪һ�����������ӣ���ֻ��NO3�����ӷ��ϣ�
������г������ܹ����ɳ�������Fe3+���ӡ�Fe2+���ӻ�Al3+�����е�һ�ֻ��֣���������������Fe2+������NO3�����ӷ���������ԭ��Ӧ�����ܹ��棬��һ������Fe2+���ӣ�
������������Һ��һ������H+���ӡ�NO3�����ӣ�һ��û��AlO2����CO32����Fe2+���ӣ�Fe3+���ӡ�Al3+����������һ�֣�
��ѡD��
������ ���⿼�鳣�����ӵļ��飬ע��ӷ�Ӧ�������ƶ����ӵĴ����ԣ��������ʵ����ʺ����ӵļ��鷽����������Ĺؼ�����Ŀ�ѶȲ���
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1��ԭ������11��17��Ԫ�أ����Ƶ��ȣ����Ӳ�����ͬ���������������������ӵ����������ź˵�������ε�����ԭ�Ӱ뾶�����������˶������ӵ�������������ʧ�����������������õ�����������������ˣ��������������ǽ�������������
��2��Ԫ�ؽ����Ե�ǿ�������Դ����ĵ�����ˮ����ķ�Ӧ�û���������̶ȣ��Լ���������������ˮ���������ǿ�����жϣ�Ԫ�طǽ����Ե�ǿ�������Դ���������������ˮ���������ǿ���������ĵ��ʸ�����������̬�⻯����������⻯����������жϣ�
��3��Ԫ�ص���������ԭ�������ĵ������������ı仯��������ɽ���Ԫ�������ɣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʵ������ȡ�����������װ������ͼ��ʾ�������������������գ�
��1��Բ����ƿ�м���ķ�Ӧ�����廯�ơ�������1��1�����ᣮ���������1��1���������õĶ�������Ϊ������ѡ���ţ���
a����ƽ b����Ͳ c������ƿ d���ζ���
��2��д������ʱ��ƿ�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ������
��3���������ﵼ��ʢ�б�ˮ�������Թ�A�У���ˮ������������������
�Թ�A�е����ʷ�Ϊ���㣨��ͼ��ʾ���������ڵ������㣮
��4���Թ�A�г��˲����ˮ֮�⣬�����ܴ���������������д����ѧʽ����
��5����Ũ���������ʵ�飬���Թ�A�л�õ��л�����ػ�ɫ����ȥ�������ʵ���ȷ������������ѡ���ţ���
a������ b������������Һϴ��
c�������Ȼ�̼��ȡ d��������������Һϴ��
���Թ�B�е����Ը��������Һ��ɫ��ʹ֮��ɫ�����ʵ�������������
��6��ʵ��Ա��ʦ���������װ���е��������Ӳ��ֶ��ijɱ������ӿڣ���ԭ���ǣ�������
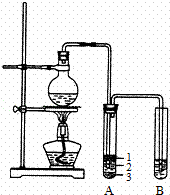
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ʳƷ�㾫������������·�ߣ���Ӧ������ȥ����ͼ��ʾ����������������ǣ�������
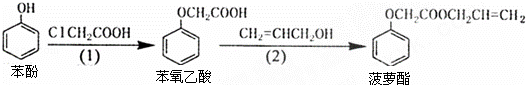
�� A�� ���裨1�������в����ı��ӿ���FeCl3��Һ����
�� B�� ���裨2�������в�����ϩ����������ˮ����
�� C�� ���ӺͲ���������������KMnO4��Һ������Ӧ
�� D�� ��������Ͳ�����������NaOH��Һ������Ӧ
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��һ�������¿ɺϳɷ����廯����E��G�ڱ�״���������壬������µ��ܶ�Ϊ1.25g/L�������ʼ��ת����ϵ������ʾ��
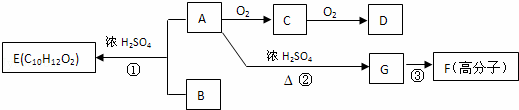
��ش��������⣺
��1��G�еĹ��������������û�ѧʽ��ʾ����D�еĹ�����������������F�Ľṹ��ʽ������
��2��ָ����Ӧ���ͣ�������������������������
��3����������������B��ͬ���칹���������֣�
����FeCl3��Һ����ɫ ���ܷ���������Ӧ �۱�����ֻ������ȡ����
��4��д����ѧ����ʽ��A��C������
C�����Ƶ�������ͭ����Һ��Ӧ��������
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ�к��е����ӿ�����K+��Ba2+��A13+��Mg2+��AlO2����CO32����SiO32����Cl���еļ��֣��ֽ�������ʵ�飺
��ȡ������Һ������������Һ�������������ɣ�
����ȡ����ԭ��Һ����μ���5mL0.2mol•L��1���ᣬ�����������ǣ���ʼ���������������࣬���������������������壬��������������ʧ��
���������ڳ�����ʧ�����Һ�У��ټ�����������������Һ�ɵõ�����0.43g��
����˵������ȷ���ǣ�������
�� A�� ����Һ��һ������Ba2+��Mg2+��A13+��SiO32����Cl��
�� B�� ����Һ��һ������K+��AlO2����CO32����Cl��
�� C�� ����Һ�Ƿ���K+������ɫ��Ӧ������ɫ�ܲ���Ƭ��
�� D�� ���ܺ���Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ����Fe2+��Na+��Al3+��Ba2+��SO42����NO3����Cl���е�4�����ӣ��������ӵ����ʵ�����Ϊ1mol���������Һ�м��������ϡ���ᣬ���������������Һ������������䣨������ˮ�ĵ�������ӵ�ˮ�⣩������˵������ȷ���ǣ�������
�� A�� ����Һ�������������ǣ�Fe2+��Na+��SO42����NO3��
�� B�� �������Һ�м��������ϡ���ᣬ�����������ڿ������ܱ�ɺ���ɫ
�� C�� �������Һ�м��˹�����ϡ�����KSCN��Һ����Һ��Ѫ��ɫ
�� D�� �������Һ�м���������NaOH��Һ����ַ�Ӧ���ˡ�ϴ�ӡ����գ��������ù��������Ϊ72g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CaCO3��ϡ���ᷴӦ�����ȷ�Ӧ������CO2�����뷴Ӧʱ��Ĺ�ϵ��ͼ�����н�����ȷ���ǣ���

A�� ��Ӧ��ʼ4 min���¶ȶԷ�Ӧ���ʵ�Ӱ���Ũ��С
B�� ��Ӧ4 min��ƽ����Ӧ������С
C�� ��Ӧ��ʼ2 min��ƽ����Ӧ�������
D�� ��Ӧ�ڵ�2 min����4 min������CO2��ƽ����Ӧ����Ϊ v��CO2��=0.1 mo1•��L•min��﹣1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ���ǣ�������
| �� | A�� | ����������ȩ������������ȫȼ��ʱ����������������� |
| �� | B�� | ����ˮ������ղ����ڼ��������¿�������������ͭ��Ӧ����ש��ɫ���� |
| �� | C�� | ���ñ���̼������Һ��ȥ���������е����� |
| �� | D�� | 2﹣��﹣2﹣���������������ƵĴ���Һ�м��ȿ����ɼ���ϩ |
��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com